"Eh bien, j'ai encore attrapé le virus !" Alors, en scrutant de près l'échelle du thermomètre chaud, les parents nous informent de l'existence de ces mystérieux petits trucs sales. En plus de la contrariété, il y a des notes alarmantes dans les voix des adultes. Tous les parents ne savent probablement pas que le mot « virus » est traduit du latin par « poison », mais tout le monde a certainement entendu parler des grandes épidémies du passé et des menaces mortelles qui menacent les mégalopoles modernes - comme la grippe, l'hépatite, le sida... Et alors ? De quel genre de créatures ou de substances s'agit-il : des virus ? Et sont-ils si effrayants ?
En général, les virus sont merveilleux. Ils ont fière allure et sont parfaitement adaptés pour utiliser n'importe quel organisme vivant à leurs fins : animaux, plantes, champignons, protozoaires, bactéries et archées. Et même des créatures non cellulaires, des virus frères.
Comment fonctionnent les virus ?
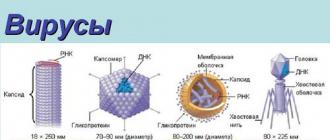
Dans le cas le plus simple, un virus consiste en génome(molécule d'acide nucléique simple ou double brin) et enveloppe protéique. S'il n'y a pas de shell, alors l'objet n'atteint pas le titre de virus et se contente du nom viroïde. Acide nucléique - ADN ou ARN- code pour les protéines nécessaires à la reproduction du virus. Dans certains virus, le génome contient des instructions pour construire seulement quelques protéines, dans d'autres, deux mille ou plus. enveloppe protéique, ou capside, protège l'acide nucléique des dommages et se compose de plusieurs parties répétitives - capsomères, qui, à leur tour, sont construites à partir de molécules d’un ou plusieurs types de protéines. La capside peut avoir la forme d'un icosaèdre (vingt-èdres, mais pas toujours réguliers), d'un fil ou d'un bâton, ou elle peut combiner différentes formes : par exemple, dans la plupart des virus bactériens - bactériophages- la « tête » icosaédrique est montée, comme une glace, sur un processus creux en forme de tige.
Mais tous les virus ne sont pas conçus aussi simplement : certains sont recouverts par des virus supplémentaires, volés à l'hôte et légèrement modifiés. membrane lipidique, chargés de protéines hôtes et virales - ils sont très utiles pour infecter de nouvelles cellules. C'est le cas, par exemple, de la grippe et des virus de l'immunodéficience humaine (VIH). Les virus très complexes, par exemple le virus de la vaccine ou le mimivirus, peuvent se vanter de « vêtements » multicouches. Ils sont capables de transporter dans leurs particules de nombreuses molécules utiles - enzymes et facteurs nécessaires à la construction de nouveaux virions. La plupart des virus sont obligés de s’appuyer uniquement sur le système de synthèse des protéines de l’hôte.
Comment les virus se reproduisent-ils ?
Si une cellule vivante se reproduit par division, le virus copie à plusieurs reprises ses « parties de rechange » dans la cellule affectée. Aucune cellule d'un organisme ne lui convient - elle en a besoin d'une cellule spéciale, que le virus reconnaît grâce à des molécules spéciales à la surface de la cellule, récepteurs. Par conséquent, les humains n'ont pas peur de nombreux virus provenant d'autres mammifères et le VIH ne peut commencer ses activités subversives qu'après un contact avec des cellules spécifiques du système immunitaire. Lorsque la rencontre tant attendue a lieu, le virus pénètre dans la cellule par des dommages (comme les virus végétaux aiment le faire) ou en fusionnant son enveloppe externe avec la membrane cellulaire, ou peut injecter son génome comme une seringue à travers la paroi cellulaire (la plupart des bactériophages le font). ceci) ou être avalé par la cellule elle-même, qui n'a pas remarqué le piège.
Dans la cellule, le virus se « déshabille » complètement ou partiellement. Si le génome du virus est représenté par de l'ADN, alors le processus de copie, ou réplication, se produit dans le noyau cellulaire. La plupart des virus commencent à exploiter les enzymes hôtes étrangères à partir de ce stade. Pour produire d’autres composants du virion, il est nécessaire de réécrire les informations contenues dans l’ADN dans un langage légèrement différent. Commence transcription: Les copies d'ADN sont utilisées pour synthétiser des brins d'ARN - intermédiaires qui vont transmettre ( diffuser) instructions stockées dans l'ADN pour les machines de fabrication de protéines cellulaires. Ce n’est que sur la base de tels intermédiaires que les protéines peuvent être construites. Cela se produit déjà dans le cytoplasme et, bien sûr, dans l'équipement hôte. ribosomes. Autrement dit, le virus oblige la cellule à travailler uniquement pour elle et à sacrifier ses besoins. La cellule souffre d’une déficience propre et de la production de substances étrangères et peut même se suicider. Mais même sans cela, son sort n’est pas enviable. De nouveaux composants de la capside virale se lient à de nouvelles molécules d'acide nucléique - un auto-assemblage de virions se produit, qui peuvent jaillir de la cellule comme une guérilla, enveloppés dans sa membrane, ou peuvent sauter en une seule impulsion précipitée, et la cellule estropiée va éclater ( lyses).
Les virus les plus prudents se cachent « étroitement » jusqu’à ce qu’ils estiment que le moment est venu de se reproduire activement. Il s'agit par exemple des virus de l'herpès et de certains bactériophages. Certains d’entre eux n’ont jamais le temps de se réveiller.
Et les virus des virus nuisent généralement rarement à leurs « hôtes ». Et il est difficile de qualifier les virus d’hôtes. C’est juste que leurs usines de production de virions sont utilisées par des virus hôtes sans rien demander. C'est vrai, certains types - virophages- peut favoriser la survie des cellules souffrant de ces mêmes « hôtes ».
Tous les virus sont-ils des méchants ?
Non seulement les humains, mais aussi les animaux et les plantes souffrent de virus. Cependant, ces organismes vivants complexes ont rencontré des virus depuis leur création et se sont donc adaptés pour coexister avec la plupart d’entre eux. Et, en règle générale, le virus n'a pas besoin de tuer ses hôtes - il devra alors en chercher de nouveaux à tout moment, et si dans des communautés bactériennes surpeuplées cela n'est pas si difficile, alors chez l'homme...
Les systèmes de défense de notre corps résistent bien à la plupart des virus, c'est pourquoi rien de spécial n'a même été inventé pour le traitement des troubles intestinaux légers et des « rhumes » provoqués par divers agents. Pendant que vous recherchez le véritable coupable, la personne est déjà en train de se rétablir. De plus, les virus peuvent aussi être nos alliés : en prenant les virus comme exemple, les biologistes étudient divers processus moléculaires, et ils sont également utilisés pour le génie génétique ; dans le même temps, les bactériophages sont capables de lutter contre les bactéries pathogènes, et certains virus de l'herpès « dormants » peuvent être capables de protéger contre l'infection... par la peste.
Mais si nous ignorons le bien et le mal, d'un point de vue humain, des virus, nous devons admettre que notre monde repose en grande partie sur ces créatures invisibles : elles transfèrent leurs propres gènes et ceux des autres d'un organisme à l'autre, augmentant ainsi la diversité génétique, et régulent le nombre de communautés d'êtres vivants et sont simplement nécessaires à la circulation des nutriments, car les virus sont les objets biologiques les plus nombreux sur notre planète.
Réponses:
Les virus ont besoin d'une cellule pour se reproduire. Après avoir pénétré dans la cellule, le virus intègre son acide nucléique, qui transporte des informations héréditaires à son sujet, dans le chromosome de la cellule hôte et la « force » ainsi à travailler selon son programme - pour synthétiser les composants des particules virales (reproduction). L'accumulation de particules virales entraîne leur sortie de la cellule.
Généralement, le virus se lie à la surface de la cellule hôte et y pénètre. De plus, chaque virus recherche exactement « son » hôte, c’est-à-dire des cellules d’un type strictement défini. Ainsi, le virus, l'agent causal de l'hépatite, autrement appelé jaunisse, pénètre et se multiplie uniquement dans les cellules du foie, et le virus des oreillons, dans le langage courant des oreillons, uniquement dans les cellules des glandes salivaires parotides humaines. Après avoir pénétré à l'intérieur de la cellule hôte, l'ADN ou l'ARN viral interagit avec l'appareil génétique de l'hôte de telle sorte que la cellule, involontairement, commence à synthétiser des protéines spécifiques codées dans l'acide nucléique viral. Cette dernière se réplique également, et l'assemblage de nouvelles particules virales commence dans le cytoplasme de la cellule. Une cellule infectée par des virus peut littéralement « éclater » et un grand nombre de particules virales en sortiront, mais parfois les virus sont libérés de la cellule progressivement, un à la fois, et la cellule infectée vit longtemps.
Les virus se reproduisent toujours à l’intérieur des cellules d’un organisme vivant, ils ne peuvent donc pas être cultivés dans des milieux nutritifs artificiels ou dans des conditions extérieures. Après avoir pénétré dans le corps d'une personne, d'un animal, d'une plante ou d'une bactérie, ces petites créatures subissent plusieurs étapes de transformation, à la suite desquelles se forment des virions filles.
Virus de la grippe
La classification des virus est basée sur :
- leurs variétés d'acides nucléiques ;
- structure interne;
- la nature de la symétrie ;
- localisation de la reproduction dans la cellule;
- qualités antigéniques ;
- présence de capside, etc.
Parmi les caractéristiques énumérées, le type NK est de la plus haute importance. En fonction du nombre de fils, on distingue les virus contenant de l'ARN et de l'ADN. Ils présentent des différences de composition chimique. Les micro-organismes contenant de l'ADN circulaire double brin contiennent de la thymine et du désoxyribose, tandis que les virus contenant de l'ARN simple brin contiennent de l'uracile et du ribose.

De quoi est constitué un virus ?
En microbiologie, il existe deux types de virus :
- Simple. Ils contiennent un acide nucléique, porteur d'informations génétiques, et une protéine spécifique, qui permet de reconnaître ces micro-organismes lors des diagnostics en laboratoire.
- Complexe. En plus des composants répertoriés, ils contiennent des lipides, des glucides et des enzymes impliqués dans la reproduction des agents pathogènes.
Pour la plupart, l'acide nucléique est situé dans la partie centrale. Il est entouré d'une coque protéique (capside), constituée de capsomères.

Les virions complexes sont en outre enfermés dans une enveloppe externe constituée de protéines, de glycoprotéines et de lipides.
Cycle de vie
Le virus est le seul organisme vivant qui ne peut pas survivre seul. Par conséquent, son cycle de vie commence à partir du moment où il pénètre dans les cellules hôtes, où il utilise activement les nutriments pour créer une progéniture et infecter d’autres cellules.
Le micro-organisme pénètre dans l'organisme hôte :
- par des dommages mécaniques à la peau et aux muqueuses (plaies, coupures, fissures, écorchures) ;
- avec de l'air inhalé ;
- avec des piqûres d'insectes hématophages.
Ayant atteint les structures sensibles, l'agent pathogène s'attache à la membrane cellulaire, se lie à ses protéines, pénètre à l'intérieur par le trou résultant et commence la reproduction de la progéniture. Au cours de ce processus, les acides nucléiques et les protéines sont produits séparément, qui sont ensuite assemblés en nouveaux virions.
Après avoir utilisé toutes les ressources de la cellule hôte, un grand nombre de virus détruisent sa membrane, sortent et envahissent de nouvelles « victimes ». Ensuite, le cycle de vie se répète.
Conditions de reproduction
Pour se reproduire, le virus a besoin d’une cellule vivante. La réplication de certains micro-organismes se produit simultanément dans le cytoplasme, d’autres dans le noyau et d’autres encore dans les deux structures.
Mais il existe des représentants dont la reproduction nécessite la présence de virions d'une espèce différente.
Types de reproduction virale
La plupart des virus sont caractérisés par un type de reproduction disjonctif, dans lequel leurs NK et leurs protéines sont d'abord synthétisées séparément puis assemblées en virions.
Le cycle de reproduction des virus peut se terminer par la lyse cellulaire (voie lytique) ou l'incorporation d'acide nucléique dans le chromosome hôte (voie intégrative), suivie d'une réplication et d'un fonctionnement en tant que partie constitutive de son génome.
Comment les virus se reproduisent : étapes
Un moyen productif de reproduire des virus. Elle se termine par la formation de nouvelles particules virales et la destruction (lyse) de la cellule affectée. Cette méthode se déroule en plusieurs étapes. C’est ainsi que la plupart des micro-organismes pathogènes interagissent avec les cellules. Mais il existe deux autres façons de reproduire des virus lorsque l'intégrité de la membrane cellulaire n'est pas violée :
- type abortif : le processus de réplication s'arrête à l'une des phases et ne se termine pas par l'apparition de nouveaux virions ;
- type intégratif : intégration de la molécule d’ADN viral dans le chromosome hôte, suivie d’une réplication conjointe.
Le schéma de reproduction productive des virus commence par leur désintégration en NK et en protéines. Ensuite, l’acide nucléique perd sa coque protectrice (capside) et commence à reproduire des structures similaires à lui-même, selon les informations qu’il contient. Parallèlement, la synthèse des enzymes nécessaires à la réplication des NK et des protéines est déclenchée dans la cellule infectée.
Après avoir traversé une séquence d'étapes de reproduction des virus contenant de l'ADN, leur génome double ou plus, se combine avec des protéines et forme des virions filles.
Il a été établi que le cycle complet de la séquence des étapes de reproduction des micro-organismes contenant de l'ADN comprend 6 phases.
Adsorption
Le stade initial de la reproduction est caractérisé par la fixation du virion à la paroi externe d'une cellule vivante. Le processus se déroule en 2 étapes :
- phase non spécifique, dans laquelle l'attraction du micro-organisme et de la membrane cellulaire se produit grâce aux liaisons ioniques ;
- une phase hautement spécifique au cours de laquelle des protéines virales spécifiques (d'attachement) reconnaissent et interagissent avec des récepteurs cellulaires spécifiques.

Des récepteurs cellulaires spéciaux déterminent le tropisme des agents pathogènes. Le tropisme consiste à cibler des virus d'un certain type pour qu'ils vivent et se reproduisent dans des cellules d'un certain type. Ainsi, le virus de l'hépatite a un tropisme pour les cellules hépatiques (hépatotrope), le VIH est immunotrope, l'herpès est neurotrope, etc.
Pénétration dans une cellule vivante
Il existe plusieurs mécanismes de pénétration des particules virales dans les cellules :
- Viropexie. Une fois que le virion s'est attaché à la membrane cellulaire, il commence à s'invaginer vers l'intérieur, formant progressivement une nouvelle inclusion (endosome) contenant le virion. Une fusion ultérieure de l'enveloppe protéique-graisse du micro-organisme avec la membrane de l'endosome conduit à la libération de sa nucléocapside dans le cytoplasme. Les composants restants sont détruits par les lysosomes de l'hôte.
- Combiner la coquille d'un micro-organisme avec la membrane cellulaire. Cette méthode n'est typique que pour les microbes qui possèdent des protéines de fusion qui interagissent de manière ponctuelle avec les particules grasses de la membrane. Grâce à cette intégration, la composante interne du virus pénètre dans le hyaloplasme cellulaire.
- Une combinaison des deux mécanismes décrits.
Le mécanisme de pénétration des virus dépend de leur espèce. Il détermine également le tropisme envers les cellules bactériennes, les unités structurelles des plantes, des champignons, des humains ou des animaux.
Réplication des acides nucléiques
La synthèse d'une molécule d'acide nucléique assure l'accumulation dans la cellule de nombreuses copies virales, qui sont ensuite utilisées dans la formation de virions. Le type de ce mécanisme dépend du type de NK, de la présence de polymérases cellulaires et de la capacité des micro-organismes à favoriser leur formation.

Synthèse des protéines
Dans l’unité structurelle infectée du corps, le génome du virus code pour la formation de deux types de molécules protéiques :
- des protéines non structurales qui assurent le processus de reproduction ;
- protéines structurelles qui composent le virion.
La formation des protéines se fait selon le type de transcription : l’information génétique intégrée dans la matrice synthétise de nombreux ARN viraux. Cette information est ensuite traduite vers les ribosomes, où elle est lue et où des protéines se forment.
Le transfert d'informations héréditaires dans les virus contenant de l'ADN s'effectue par la transcription de l'ARNm (ARN messager) et la traduction des protéines virales. Pour cela, ils utilisent une enzyme appelée polymérase cellulaire.
Dans certains virus, la construction de protéines se produit également sous l'influence d'enzymes bactériennes synthétisées ou de leurs propres polymérases, qui accélèrent la formation de nouvelles unités structurelles d'ARN.
Pour former des virions, leurs éléments constitutifs sont transportés vers certaines parties du noyau ou du cytoplasme de l'hôte, où ils sont reliés par une correspondance « à clé », ainsi qu'à l'aide de liaisons hydrogène, hydrophobes et autres.

Les micro-organismes viraux se caractérisent par une synthèse protéique en plusieurs étapes avec formation de formes intermédiaires.
- Lorsque des microbes simples sont assemblés, la formation de nucléocapsides se produit grâce à la combinaison de protéines NC et de capside.
- Dans les virus complexes, les nucléocapsides résultantes continuent d’interagir avec la membrane cellulaire, formant leur propre supercapside lipoprotéique.
Sortie de la cellule hôte
Les virions peuvent sortir d’une cellule infectée de deux manières.
- Explosif. Le résultat est la destruction de la cellule hôte mourante.
- Exocytose inhérente aux micro-organismes enfermés dans une coque lipoprotéique. Au premier stade, la nucléocapside formée est amenée à la membrane cellulaire, qui commence à faire saillie et à se séparer sous la forme d'un bourgeon, qui est un virion à part entière. La cellule elle-même ne perd pas sa viabilité et est capable de produire davantage de virions.

Options possibles
Les écarts existants par rapport au modèle général de réplication obligent les scientifiques à découvrir quelles caractéristiques de reproduction des phages et des virus existent encore.
Des virus ont été découverts qui synthétisent des protéines qui capturent uniquement des sections individuelles d'acides nucléiques. Si des virions se forment et contiennent une quantité insuffisante d’informations génétiques, ils deviennent alors non infectieux.
Qu'est-ce que la période de latence
Pour des raisons inconnues, certains virus, après avoir pénétré dans les structures vivantes, s'intègrent dans leurs chromosomes et se transmettent lors de la reproduction aux éléments filles pendant un certain temps. Ce comportement des micro-organismes est appelé latence.
Lorsqu'un facteur provoquant apparaît, les agents pathogènes sont activés, commencent à se multiplier activement et provoquent des maladies.
Comment le système immunitaire empêche les virus de se multiplier
Une fois que les virus pénètrent dans l'organisme, des facteurs du système immunitaire sont activés qui bloquent leur reproduction :
- Macrophages. Ils stimulent la synthèse des immunoglobulines, qui chassent les agents étrangers du cytoplasme et des organites des structures cellulaires.
- Interférons. Éléments innés non spécifiques de l’immunité. Ils commencent à agir dès le premier moment où les virus pénètrent dans l’organisme, bloquant la protéine kinase cellulaire, qui catalyse la réplication. Les interférons provoquent également l'activité de l'endonucléase, qui détruit l'ARN viral. Ainsi, ces facteurs du système immunitaire n’entrent pas en contact direct avec l’agent infectieux, et ne permettent donc pas de développer une méthode de défense contre eux-mêmes.
- Cellules tueuses NK qui tuent leurs propres structures cellulaires infectées par phagocytose. Ils provoquent la libération de la protéine perforine, située dans les inclusions cytoplasmiques, et son intégration dans la membrane cellulaire affectée. En conséquence, des pores se forment, à travers lesquels pénètrent les enzymes, déclenchant le processus d'autodestruction de l'élément affecté.
- Complément et lymphocytes T, liés à des facteurs immunitaires spécifiques et ayant un effet néfaste directement sur les virions.
Malgré l’abondance de facteurs de protection, le système immunitaire n’est pas toujours capable de résister à la prolifération des microbes. Par exemple, les agents responsables de l'hépatite chronique C, B ou de l'herpès restent longtemps dans le corps, sans présenter de symptômes cliniques, mais le détruisent progressivement et provoquent des rechutes de maladies.
Aide aux tests de biologie scolaire
« Quand les virus ne se reproduisent-ils pas ?
Les virus ne se reproduisent pas s’ils se trouvent en dehors d’une cellule vivante.
"Nommer les signes de reproduction du virus dans les cultures cultivées"
La multiplication des virus dans une culture cellulaire cultivée est mise en évidence par des changements morphologiques dans les cellules résultant de l'action cytopathique de micro-organismes. Au microscope, vous pouvez détecter les cellules détruites qui se sont décollées des parois des tubes à essai, ainsi que des sections individuelles de cellules restant de la monocouche.
« Quelle méthode de reproduction est inhérente aux virus ? »
La méthode de reproduction des virus est asexuée. Elle s'accompagne d'une dissolution de l'enveloppe, d'une dégradation en acides nucléiques et en protéines, suivies de leur réplication et de leur combinaison en de nouveaux virions. Les virus se reproduisent uniquement lorsqu'ils pénètrent dans une cellule vivante.
« Le virus est-il capable de s’auto-répliquer ?
"Quelles sont les caractéristiques de la reproduction des virus bactériophages ?"
La reproduction des bactériophages se déroule selon le principe du cycle lytique, qui comprend les phases suivantes :
- adsorption de particules de bactériophages à la surface des bactéries ;
- pénétration du composant actif dans la cellule;
- restructurer le métabolisme de la bactérie et la provoquer à répliquer l'ADN du bactériophage ;
- mort cellulaire due à la violation de l'intégrité de la membrane et à la libération de phages dans l'environnement extérieur.
« Caractériser le mécanisme de reproduction du virus »
Les virus sont caractérisés par un mécanisme de reproduction disjonctif dans lequel, après pénétration dans une cellule vivante, ils se désintègrent en protéines et en acides nucléiques, suivis d'une réplication, d'une formation et d'une libération de nouveaux virions dans l'espace intercellulaire.

Je travaille comme médecin vétérinaire. Je m'intéresse à la danse de salon, aux sports et au yoga. Je privilégie le développement personnel et la maîtrise des pratiques spirituelles. Sujets favoris : médecine vétérinaire, biologie, construction, réparations, voyages. Tabous : droit, politique, technologies informatiques et jeux informatiques.
Mécanismes de pénétration du virus dans la cellule hôte
Mécanismes de pénétration du virus dans la cellule hôte
Pour se reproduire, le virus utilise le système de synthèse des protéines de la cellule hôte, c'est-à-dire qu'il doit pénétrer profondément dans la cellule. Premièrement, le virus interagit avec une surface sur laquelle se trouvent des sites récepteurs spéciaux. Sur sa coquille se trouvent des protéines d'attachement correspondantes qui réagissent avec ces zones. Les virus sont donc très spécifiques et n’infectent qu’un certain type de cellules d’un certain type d’organisme. La présence de tels sites récepteurs détermine leur sensibilité à un type particulier de virus.
Le virus peut s’attacher à d’autres endroits de la surface cellulaire, l’infection peut alors ne pas se produire.
Dans les virus simples, les protéines d’attachement sont contenues dans l’enveloppe protéique. Dans les virus complexes, ils se trouvent à la surface d’une membrane supplémentaire et ont la forme de pointes, d’aiguilles, etc.
Voies permettant aux virus de pénétrer dans les cellules
Les virus peuvent pénétrer dans une cellule de plusieurs manières :
- Les enveloppes virales peuvent fusionner avec la membrane cellulaire (par exemple, le virus de la grippe).
- Le virus pénètre dans la cellule par pinocytose. Dans ce cas, les enzymes de la cellule hôte brisent sa membrane et libèrent de l'acide nucléique (par exemple, le virus de la polio animal).
- À travers les zones endommagées de la paroi cellulaire des cellules végétales. Ensuite, ils passent d’une cellule à l’autre le long de ponts cytoplasmiques.
Les bactériophages disposent d'un mécanisme complexe pour la pénétration des virus dans les cellules bactériennes. À l'aide de filaments de queue, ils se connectent aux sites récepteurs des cellules bactériennes. Après fixation, par exemple, le bactériophage T4, du fait de la contraction de la gaine, injecte une molécule d'acide nucléique profondément dans la cellule à travers une tige creuse. La coquille vide du bactériophage reste à l'extérieur.
Reproduction de virus et variantes de résidence du virus dans une cellule
Les virus qui pénètrent dans une cellule peuvent devenir actifs immédiatement ou ultérieurement, c'est-à-dire rester dormants pendant un certain temps. Les options suivantes pour la présence de virus dans une cellule sont possibles :
- Infection lytique(du grec lyse– destruction, dissolution) – les virus formés quittent simultanément la cellule et la déchirent. La cellule meurt.
- Persistant(persistant) – de nouveaux virus apparaissent progressivement. La cellule vit et se divise, même si son fonctionnement peut changer.
- Latent(caché) - le matériel génétique du virus est intégré dans l'ADN des chromosomes et lors de la division cellulaire, il est transmis aux cellules filles. Le processus d'insertion de l'acide nucléique dans l'ADN du chromosome de la cellule hôte est appelé l'intégration. L'acide nucléique intégré d'un virus dans le génome de la cellule hôte, formé à partir d'ARN grâce à des enzymes, est appelé virus. Divers facteurs (nature physique, biologique et chimique) peuvent activer le provirus. Une infection lytique ou persistante se développe alors.
La réplication virale implique trois processus principaux : la réplication de l'acide nucléique viral, la synthèse des protéines virales et l'assemblage des virions. Dans la cellule hôte, l'acide nucléique du virus transmet des informations héréditaires sur les protéines virales à l'appareil de synthèse des protéines de la cellule.
Dans les virus contenant de l'ARNm, il se lie immédiatement aux ribosomes de l'hôte et provoque la synthèse de protéines virales. Dans d’autres virus, l’ARNm est synthétisé à partir de l’ARN ou de l’ADN du virus.
Certains virus à ARN (par exemple le VIH, le virus de l'immunodéficience humaine) peuvent provoquer la synthèse d'ADN dans le noyau cellulaire. L'ARNm viral est synthétisé à partir d'une molécule d'ADN. C'est ce qu'on appelle un phénomène réplication inverse.
Certains virus (par exemple certains bactériophages et virus responsables de certains cancers) intègrent l’ADN viral dans l’ADN des cellules hôtes. Si la synthèse a lieu, elle se fait en combinaison avec les protéines cellulaires. Les protéines virales modifient les propriétés des cellules et ne les tuent pas. Ainsi, les cellules cancéreuses se divisent fréquemment. Leur nombre augmente de manière illimitée.
Grâce à leurs propres produits métaboliques, les virus suppriment la synthèse des protéines des cellules hôtes. La traduction de l’information de l’ADN vers l’ARNm de la cellule s’arrête et la synthèse des propres protéines du virus est stimulée. Dans ce cas, l'appareil de synthèse des protéines de la cellule hôte et ses ressources énergétiques sont utilisés. Les molécules d'acide nucléique du virus doublent. L'acide nucléique viral est logé dans une enveloppe de protéine virale synthétisée par la cellule.
Options pour libérer des virus à partir de cellules hôtes
Il existe plusieurs options connues pour libérer des virus à partir de cellules hôtes :
- Pour la plupart, les virus détruisent la membrane de la cellule hôte, sortent et pénètrent dans d'autres cellules (par exemple les bactériophages).
- Des virus complexes bourgeonnent hors de la cellule.
- Les nouvelles générations de virus restent longtemps dans la cellule hôte, qui reste en vie jusqu'à épuisement de ses ressources énergétiques et biochimiques.
- Si je comprends bien, les virus diffèrent des microbes en ce sens qu'ils sont beaucoup plus petits ?
Oui, les virus sont si petits qu’ils traversent les plus petits pores des filtres en porcelaine qui, comme l’a établi le grand Pasteur, séparent le vivant du non-vivant. Même les plus petits microbes ne pénètrent pas à travers ces filtres.
- Les virus peuvent-ils se reproduire ?
Il n'y a qu'une seule réponse à cette question : oui, ils le peuvent, mais avec la réservation obligatoire - à condition qu'ils parviennent à pénétrer dans une cellule vivante.
Depuis la découverte des premiers virus, les scientifiques n’ont cessé de s’intéresser à une question qui n’est pas encore définitivement résolue : quelle place occupent ces plus petites créatures dans la nature ? Pour plus de clarté, vous pouvez comparer la longueur de certaines créatures vivantes : baleine - 30 mètres, souris - 5 centimètres, amibe - 50 microns, virus de la polio - 27 - 29 millimicrons.
Ainsi, le virus de la polio est environ un milliard de fois plus petit qu’une baleine ! La taille insignifiante des virus a permis à certains scientifiques de douter de leur appartenance à des êtres vivants. Cependant, la plupart des virologues ne peuvent pas être d’accord avec cela. Ils savaient que les virus pénètrent dans les cellules vivantes, s'y multiplient activement et produisent une nouvelle progéniture. C’est grâce à cette capacité à se reproduire que les virus sont classés parmi les êtres vivants.
Depuis l’école, tout le monde sait bien que les microbes se multiplient sur les milieux nutritifs artificiels. Il suffit d'ajouter une petite goutte d'une suspension de certains micro-organismes dans un flacon stérile contenant un bouillon nutritif, et au bout de quelques heures le bouillon deviendra trouble : au microscope, des milliers et des milliers de nouveaux micro-organismes peuvent être détectés. Mais les virus ne peuvent se multiplier dans aucun milieu nutritif, même de la plus haute qualité. Même si cet environnement contient l’ensemble des acides aminés, vitamines et sels nécessaires à la vie. C'est la différence radicale entre les virus et les microbes. Le virus a besoin d’une cellule vivante à part entière, et c’est seulement dans celle-ci qu’il peut se reproduire, en utilisant le métabolisme cellulaire prêt à l’emploi.
Les microbes sont capables de vivre longtemps ou simplement de survivre pour reprendre vie dans le futur, dans des conditions naturelles : dans le sol, dans l'eau, à la surface de tout objet, par exemple sur la peau humaine. Ils nécessitent un minimum de nutriments, et pour l'agent causal du choléra, de l'eau simple dans n'importe quel plan d'eau suffit.
Les virus ne survivent à l’extérieur des cellules vivantes que pendant une courte période, mieux par temps froid et bien pire par temps chaud. Si en été, en plein soleil, les virus meurent très rapidement et même à température ambiante survivent pendant une demi-heure ou une heure maximum, alors dans le gel arctique, sous des couches de glace et de neige, ils peuvent survivre pendant de nombreuses années.
Des faits confirmés par des milliers et des milliers d'observations scientifiques ont montré que les virus ne se reproduisent pas en dehors d'un organisme vivant. Il n'y avait aucune analogie entre les maladies virales et les épidémies de typhoïde provoquées par du lait contaminé ou les épidémies de botulisme associées à la consommation d'aliments en conserve avariés. Le virus devait passer (généralement assez rapidement) des cellules vivantes d’une créature aux nouvelles cellules sensibles d’une autre créature.
Dans tout processus infectieux provoqué par des virus, la maladie doit être considérée comme quelque chose qu'une personne a reçu d'une autre personne, un animal d'un autre animal. Tous les symptômes de la maladie provoquée par le virus chez une personne infectée sont associés à l'implication dans le processus infectieux de certains groupes de cellules sensibles au virus et capables de soutenir sa reproduction.
Les virus responsables du rhume se multiplient généralement dans les cellules des voies respiratoires supérieures. En conséquence, un nez qui coule et une toux commencent. Le virus de la polio pénètre dans le corps humain par la bouche et se multiplie exclusivement dans les cellules de l'intestin grêle. De là, il pénètre dans le système nerveux, où il affecte les cellules responsables des fonctions motrices des muscles. En conséquence, une paralysie des jambes, des bras et même des muscles respiratoires se développe.
Contrairement aux microbes, chaque virus possède son propre cercle d'animaux, de plantes, d'insectes et même de microbes tout à fait constant et assez limité qu'il infecte. Lorsqu'ils infectent un être vivant, les virus ne se multiplient que dans les cellules de certains tissus ou organes, et non dans aucune partie du corps.
Dans les années 1930, deux articles scientifiques parurent presque simultanément, l’un provenant d’Angleterre, l’autre d’Union soviétique. K. Smith et A. Smorodintsev ont prouvé que la grippe chez l'homme est causée par des virus et non par des microbes, comme on le pensait auparavant. Plus de 40 ans se sont écoulés depuis. De nombreuses variantes de virus grippaux ont été identifiées et toutes ont été étudiées de manière approfondie. Les scientifiques ont sélectionné un modèle de laboratoire pratique pour l'étude : une souris blanche. Il a été constaté que les virus de la grippe se multiplient intensément dans les poumons de ces animaux. Cependant, cela ne s'est produit que lorsque le virus de la grippe a été injecté dans le nez d'une souris. S'ils tentaient de l'infecter en lui injectant une suspension virale sous la peau, par voie intraveineuse ou dans la cavité abdominale, le virus de la grippe ne s'enracinait pas et ne se multipliait pas.
- Si tu ne peux pas voir le virus à l’intérieur d’une cellule à l’aide d’un microscope, comment peux-tu le faire ?
Malheureusement, un microscope ordinaire, bien qu’il grossisse les objets plus de mille fois, est impuissant face au virus.
- Comment alors faire un « portrait » du virus et voir sa structure interne ?
- La science a créé à cet effet un microscope électronique, une ultracentrifugeuse et d'autres instruments complexes.
Dès les premiers stades du développement de la virologie, les scientifiques étaient confrontés à une difficulté insurmontable : ils ne pouvaient pas voir les virus au microscope. Ils ont étudié des matériaux qui contenaient probablement des virus vivants, car ils pouvaient facilement infecter des animaux ou des plantes de laboratoire, mais aucun agent pathogène nocif n'y était visible. Jusqu'à récemment, cela était considéré comme l'une des principales propriétés des virus et de leurs différences par rapport aux micro-organismes.

De nombreux efforts ont été déployés pour surmonter l’invisibilité des virus, ce qui les rendait difficiles à étudier. Le chemin vers cette victoire s’est avéré assez long.
La difficulté était que les virus sont d'une taille négligeable - de 10 à 300 nanomètres. Il semblerait, pourquoi ne pas fabriquer un microscope avec des lentilles encore plus puissantes qui pourraient grossir un objet non pas mille, mais 10 000 ou 50 000 fois ? Mais tout reposait sur le caractère insurmontable des lois physiques.
Les lois de l'optique stipulent sans réserve que sous n'importe quel éclairage utilisé dans un microscope optique, seuls les objets dont le diamètre est supérieur à la longueur d'onde de la lumière peuvent être vus. La lumière du jour a une longueur d'onde de 400 à 700 nanomètres, par conséquent, les virus ne peuvent être vus dans aucun microscope ordinaire, aussi parfait soit-il.
Le microscope électronique vient en aide aux virologues, la théorie de sa conception et les premiers échantillons ont été créés à la fin des années 30, avant le début de la Seconde Guerre mondiale, par V. Zvorykin aux USA et A. Lebedev en URSS. Il utilise un flux d’électrons au lieu de la lumière visible et des bobines magnétiques au lieu de loupes. Après avoir traversé l'objet étudié, un mince faisceau électrique est multiplié plusieurs fois par les champs magnétiques des bobines. Cela agrandit l'image plusieurs centaines de milliers de fois et permet de la voir sur un écran fluorescent spécial, semblable à un écran de télévision. Étant donné que la longueur d'onde du faisceau électronique n'est que de 0,01 angström (angströms égaux à 0,1 nanomètre), soit 500 000 fois inférieure à celle de la lumière visible, même les petites molécules de protéines peuvent être examinées au microscope électronique.
Un microscope électronique dans ses modifications modernes est un mécanisme très précis et complexe, dont le coût se mesure en dizaines de milliers de roubles. Malgré cela, tous les laboratoires étudiant la structure des virus l’ont dans leur arsenal. À l’aide d’un microscope électronique, les scientifiques sont capables d’examiner la plupart des virus connus en les traversant avec un faisceau d’électrons.
Ces dernières années, un microscope électronique à balayage a été inventé, dont le principe de fonctionnement repose sur le fait qu'un faisceau d'électrons ne traverse pas un objet, mais, tombant sur sa surface sous un certain angle, en est réfléchi et , après le grossissement nécessaire de l'image, frappe un écran fluorescent. Un microscope électronique à balayage vous permet de voir même une image tridimensionnelle de virus, de prendre des photographies, des portraits de virus avec des détails sur la structure de leur surface externe.
L'étude de la morphologie (forme et structure) a permis de diviser tous les virus actuellement connus en trois groupes.
Les gros virus ont été étudiés en premier. Leur taille est de 200 à 300 nanomètres. Ces « géants » comprennent les virus de la variole humaine et animale, le virus de l'ectromélie de la souris blanche (cette maladie est souvent trouvée dans les pépinières où sont élevés les animaux de laboratoire si nécessaires à la science).
Le deuxième groupe comprend les virus dont la taille moyenne est comprise entre 50 et 150 nanomètres. Ceux-ci comprennent la plupart des virus végétaux, les bactériophages (virus qui détruisent les microbes), ainsi que les virus de la rougeole, des oreillons et de la grippe. Cela inclut également les agents responsables de nombreuses maladies des voies respiratoires supérieures, généralement appelées « rhumes », mais qui sont en réalité causées par de nombreux virus.
Le troisième groupe est constitué de minuscules virus (ils ne sont pas beaucoup plus gros que les grosses molécules de protéines) avec une taille de particules de 20 à 30 nanomètres. Ce groupe contient les virus de la polio, de la fièvre jaune, de l'encéphalite et de nombreux agents pathogènes des fièvres tropicales.
Les scientifiques ont calculé que si le diamètre des gros virus dépasse celui des petits de seulement 30 fois, la différence de volume est alors plus de 25 000 fois.
La grande majorité des particules virales (virions) qui infectent les humains et les animaux sont de forme sphérique, tandis que les virus végétaux ont un cylindre allongé. Bien que la longueur du cylindre du virus de la mosaïque du tabac atteigne 350 nanomètres, elle est toujours invisible au microscope optique : le diamètre du cylindre ne dépasse pas 15 nanomètres, et de telles valeurs ne sont pas visibles au microscope optique.
Les recherches du désormais célèbre biochimiste américain et prix Nobel W. Stanley débutent en 1935 et mettent alors en lumière la composition des virus. À partir du jus de plantes infectées par le virus de la mosaïque du tabac, Stanley a isolé des composés de haut poids moléculaire. Après une purification minutieuse, il s’est avéré qu’il s’agissait d’une combinaison complexe d’acide nucléique et de protéine. Cette substance est appelée nucléoprotéine. Il pourrait même infecter des plantes saines, provoquant une maladie appelée mosaïque du tabac.
Cependant, les différences les plus significatives entre virus et microbes ont été découvertes lorsque les virus ont été, pour ainsi dire, désassemblés en leurs composants. Ces dernières années, la science a créé de nombreuses nouvelles enzymes et réactifs afin de séparer les uns des autres les différents composants du corps d'un virus ou d'une cellule microbienne avec une précision plus que précise, de les obtenir sous leur forme pure et de les étudier avec suffisamment de précision. Il est même difficile d’imaginer cette précision avec laquelle les scientifiques opèrent avec des quantités mesurées en millionièmes de micron !
Les virus ont été exposés aux rayons X sous différents angles, l'ampleur des vibrations électromagnétiques de leurs atomes a été mesurée, les protéines virales et les acides nucléiques ont été séparées et la séquence d'acides aminés dans la protéine a été déterminée. L’analyse de tous les faits a été réalisée à l’aide d’ordinateurs électroniques sophistiqués en quelques jours, et non sur plusieurs années, comme cela s’est fait tout récemment. Et grâce à une étude aussi scrupuleuse des virus, il a été possible d'établir un fait tout à fait inattendu : ils n'ont aucune ressemblance avec l'organisation cellulaire typique de tous les organismes existant sur terre !
Au centre de chaque virion, formant son noyau, se trouve un acide nucléique. À l’extérieur se trouvent des molécules de protéines qui forment une sorte de revêtement protecteur, appelé « couverture ». Ils sont constitués de 20 acides aminés bien connus, à partir desquels sont tissées les molécules protéiques de toutes les créatures vivant sur terre.
Pour déterminer le poids d’une particule virale entière ou de ses composants individuels, une ultracentrifugeuse est utilisée. Elle diffère d'une centrifugeuse conventionnelle en ce qu'elle développe une vitesse de rotation d'environ 100 000 tours par minute et crée une force de gravité qui dépasse la gravité de plusieurs centaines de milliers de fois.
Si vous placez un tube à essai contenant une solution concentrée de sucre ou de sel dans une ultracentrifugeuse et une suspension du virus dessus, alors à certaines vitesses de rotation, le virus se déposera et se déplacera vers le fond du tube à essai, comme s'il est pressé à travers une couche dense de la solution sous-jacente. Sur la base de la profondeur d'immersion du virus dans une solution dense de sucre ou de sel, le poids moléculaire de la particule ou de ses composants individuels peut être calculé.
L'unité de mesure était le dalton - le poids du plus petit atome naturel - l'atome d'hydrogène. Il s'est avéré que dans le petit virus de la polio, le poids de l'ARN viral, qui est le génome, gardien de l'information héréditaire du virus, ne dépasse pas 1 à 2 millions de daltons, tandis que dans le grand virus de la variole, il atteint 200 millions. . Et le poids moyen du génome d'une cellule bactérienne atteint 1 à 10 milliards de daltons.
Les acides aminés de la gaine virale sont reliés les uns aux autres de manière séquentielle selon diverses combinaisons et forment des structures en chaîne linéaire (polypeptides). Leur poids moléculaire varie de plusieurs milliers à plusieurs centaines de milliers de daltons. Ainsi, la couche externe du virus de la mosaïque du tabac forme 2 200 « éléments constitutifs » protéiques de composition totalement identique, qui sont regroupés dans le bon ordre.
La structure des différents virus varie selon un degré de complexité plus ou moins grand. Si les petits virus les plus simples sont constitués uniquement d'une molécule d'ARN et d'une protéine distinctes, les plus gros ont également une enveloppe externe, une sorte d'« enveloppe d'emballage », qui comprend non seulement des protéines, mais aussi des glucides et des lipides (substances grasses).
Les bactériophages (« mangeurs de bactéries ») ont la structure la plus complexe. Ils ont la forme d'une masse de gymnastique. Leur tête sphérique contient de l'acide nucléique. Le long processus du club est une gaine creuse construite à partir de molécules protéiques. A l'aide de ce processus, le bactériophage s'attache à la coquille ou aux flagelles des bactéries, insère la fin du processus dans le cytoplasme du microbe et injecte son acide nucléique, comme à l'aide d'une seringue.
Les protéines qui composent tout virus diffèrent par leur structure de celles des cellules affectées. Chaque protéine est un antigène, c'est-à-dire une substance pouvant provoquer la formation d'anticorps. La différence dans la structure des molécules protéiques virales et cellulaires conduit au fait que lorsqu'elles sont administrées à un animal, ces protéines provoquent la formation d'anticorps complètement différents qui ne réagissent qu'avec leurs propres antigènes. Les anticorps contre les protéines cellulaires se lient uniquement à celles-ci et ne se lient pas aux virus. Les anticorps contre le virus ne réagissent pas avec les protéines cellulaires. C'est grâce à de telles différences que des techniques de laboratoire particulières permettent de reconnaître la présence d'un virus à l'intérieur d'une cellule infectée.
- Si les virus n'ont que de l'acide nucléique et un peu de protéine protectrice, alors comment se reproduisent-ils ?
C'est le principal mystère des virus. Absence totale d'enzymes nécessaires à la synthèse des protéines et des acides nucléiques ! Et la progéniture se reproduit à une vitesse extraordinaire.
- Comment combiner les incompatibles ?
- Pour comprendre, il faut voir. Les virologues ont consacré 15 ans à cela.
On sait que dans les cellules végétales ou animales, l'acide désoxyribonucléique (ADN) remplit des fonctions héréditaires, tandis que les acides ribonucléiques (ARN) remplissent des fonctions purement auxiliaires. Cependant, de nombreux virus n'ont pas d'ADN du tout ; le génome est constitué d'une molécule d'ARN, non seulement sous forme simple brin, mais également sous forme double brin, ce qui n'est pas le cas chez d'autres êtres vivants sur terre.
La simplicité de l'organisation du virus est confirmée par la faible quantité de substance génétique, et donc la quantité d'informations génétiques qu'elle contient, par rapport à la cellule hôte dans laquelle le virus se multiplie et qu'il subordonne à ses besoins.
Une contradiction évidente se crée : le virus, possédant un volume d'informations génétiques mille fois inférieur à celui d'une cellule organisée de manière complexe, ne se retrouve jamais dans une position subordonnée, mais, au contraire, gagne presque toujours. Cela contredit tous les canons connus. Cela ne peut être compris qu’en supposant que les virus présentent des avantages décisifs sur les cellules qui facilitent leur conquête et les transforment en une sorte d’esclavage.
Avant la découverte du monde des virus, les observations à long terme de divers microbes et de tout organisme unicellulaire ont permis d'établir qu'ils se reproduisent tous exactement de la même manière : par division continue, généralement directe, lorsque deux cellules se forment à partir de une cellule, quatre d'entre elles, et ainsi de suite.
Pendant de nombreuses décennies, le processus de reproduction virale a été expliqué par analogie avec la reproduction familière et bien étudiée des bactéries. La seule chose qui restait incompréhensible était la vitesse énorme avec laquelle il marchait.

Si le nombre de virions augmentait même au rythme le plus rapide dont dispose une cellule bactérienne, c'est-à-dire trois divisions par heure, la descendance du virus subirait neuf divisions successives en trois heures et ne représenterait qu'un millier de particules. Cependant, les faits ne correspondaient pas à ces calculs et il fallait supposer que chaque division du virus en deux particules filles ne se produisait pas en 20 minutes, mais incomparablement plus rapidement.
Le premier à calculer combien de particules virales se forment lors de la reproduction fut le virologue anglais K. Andrews. En infectant une culture bactérienne avec des bactériophages, il a découvert qu'une particule de bactériophage se multiplie 100 000 fois plus vite qu'une bactérie, donnant naissance à 100 millions de particules en trois heures. Personne à l’époque ne pouvait expliquer une vitesse de reproduction virale aussi rapide et sans précédent.
De nombreux virologues de premier plan dans le monde ont trouvé une solution à cette question intéressante. Initialement, il a été établi que le virion ne se divise pas en deux particules filles, comme c'est le cas pour toutes les formes cellulaires connues sur terre. Il s’est en outre avéré que les virus ne se divisent pas du tout et qu’ils ont leur propre mécanisme de reproduction spécial, différent de tous les autres êtres vivants. Il s'est avéré que chaque particule virale « donne immédiatement naissance » à une progéniture composée de cent à mille nouveaux virions ou plus.
Dans tous les pays du monde, les scientifiques, seuls ou en équipes entières, ont contribué à la connaissance des processus invisibles se produisant à l'intérieur des cellules, littéralement au niveau moléculaire. Grâce à ces études approfondies, il a été possible de dresser un schéma assez clair des étapes successives de la reproduction ou, comme on dit plus souvent, de la reproduction des virus.
Tout commence par l'adsorption sélective du virus sur des récepteurs spéciaux situés à la surface des cellules. Après cela, certains virus dotés d'une enzyme de pénétration spéciale capable de dissoudre la membrane cellulaire (par exemple, la neuraminidase du virus de la grippe) pénètrent à l'intérieur, tandis que d'autres sont absorbés par la cellule elle-même, les prenant pour une protéine entièrement comestible.
Après avoir pénétré à l'intérieur de la cellule, le virus disparaît au sens littéral du terme, et même les méthodes les plus sensibles ne peuvent détecter ni une particule entière ni ses composants individuels dans la cellule. Les scientifiques ont même appelé cette étape de la reproduction du virus éclipse, ce qui correspond au mot russe signifiant « éclipse ».
La solution à ce paradoxe a été obtenue assez récemment. Il s'est avéré qu'au stade de l'éclipse, la particule virale se décompose en protéines et en acide nucléique. Ce « déshabillage » du virus, curieusement, est réalisé par la cellule elle-même à l'aide d'enzymes. Ils réagissent au virus envahisseur comme s’il s’agissait d’un aliment protéiné et tentent de le dissoudre et de le digérer.
Tous les principaux événements des heures suivantes, qui déterminent l'essence du processus de reproduction virale, ne sont pas associés au composant protéique du virus, mais à l'acide nucléique. C'est cela qui détermine tout le déroulement de la reproduction ultérieure des virus.
Dans des conditions normales, la vie d'une cellule est régulée par l'activité de ses propres acides nucléiques, qui dirigent la synthèse des protéines cellulaires et d'autres composés chimiques. Les chromosomes d'une cellule contiennent de nombreuses molécules d'ADN. La longue molécule de cet acide a une structure quelque peu similaire à celle d'une chaîne de vélo, tordue dans l'espace sous la forme d'une spirale. Les informations héréditaires de la cellule sur la structure de toutes les protéines qui la composent, sans exception, sont inscrites dans un énorme fil polymère, dans la double hélice de la molécule d'ADN. Il est stocké dans le noyau cellulaire.
Chaque maillon de la chaîne d'ADN est une sorte de cellule, un groupe de trois gènes, que l'on appelle un « opéron », car il réalise l'opération de délivrance des informations qu'il contient. Après tout, chaque gène est porteur d'une information héréditaire spécifique. L'un des gènes contient des informations sur la structure et la séquence de sélection des éléments de base moléculaires pour la synthèse d'une molécule protéique strictement définie, d'une molécule d'enzyme ou d'une nouvelle molécule d'acide nucléique. Les deux autres jouent le rôle d'interrupteur et d'interrupteur pour le processus de lecture de l'information contenue dans le premier gène.
Au bon moment, l'opéron reçoit une impulsion du gène de l'opérateur de commutation. Les informations stockées dans la cellule et nécessaires à la synthèse de nouvelles molécules de protéines ou d'acides nucléiques sont libérées. Des copies et des dessins plus petits sont réalisés à partir de sections d’ADN. Ce sont des molécules d’ARN messager (ARNm). Ils se déplacent du noyau vers le cytoplasme, où se trouvent les ribosomes, une sorte de machine à produire des protéines. Il y a plusieurs milliers de ribosomes dans chaque cellule. Le diamètre de chacun est de 200 à 300 angströms et le poids moléculaire est de 2 à 5 millions de daltons.
ARN messager de plusieurs ribosomes. forme ce qu'on appelle le complexe polysomal, une sorte de matrice sur laquelle, comme dans une imprimerie à partir d'une police dactylographiée, commence l'impression (la réplication) de nouvelles copies de molécules protéiques. Les ARN de transfert (ARNt) apportent des éléments constitutifs – les acides aminés – au ribosome. Les ARNm situés sur les ribosomes (ils sont plus gros que les ARNt) servent de modèle qui détermine la séquence d'amarrage de chacun des acides aminés apportés les uns après les autres. Chaque ARNt s'attache à une région spécifique de l'ARNm. Ainsi, le long de toute la molécule d'ARNm, conformément au code qui y est intégré, des molécules d'ARNt contenant des acides aminés sont alignées. Dans le ribosome, ces blocs d'acides aminés sont réticulés les uns avec les autres et leur chaîne est polymérisée en une molécule protéique.
Une molécule de protéine s'assemble sur un ribosome en 20 à 30 secondes. Lorsqu’un nombre suffisant de ces molécules sont synthétisées, le régulateur génique entre en jeu. Il donne un signal, la section d'ADN responsable de la synthèse d'une des protéines s'éteint et ne fonctionne pas jusqu'à ce que le besoin de cette protéine se fasse à nouveau sentir dans la cellule.
Par conséquent, dans le chromosome d'une cellule saine, toutes les sections d'ADN fonctionnent selon le principe « on » - « off », régulant en permanence le nombre et l'ensemble des protéines synthétisées nécessaires à la cellule à chaque instant de sa vie. La base de tous les processus normaux de synthèse cellulaire est qu'ils sont contrôlés et dirigés par des informations transmises, pour ainsi dire, le long d'une bande transporteuse depuis l'ADN nucléaire jusqu'à l'ARN exécutif (information) des cellules.
Mais ensuite, un acide nucléique viral est entré dans la cellule. Il prend immédiatement sous son contrôle tout le métabolisme de base de la cellule, tous les processus de synthèse.
L'ennemi a capturé une usine qui fabriquait des tracteurs en temps de paix. En utilisant les mêmes machines, équipements et matières premières, les ennemis obligent les ouvriers des usines à fabriquer des chars pour leur armée afin de capturer de plus en plus de villes. Un processus essentiellement similaire se produit à l’intérieur d’une cellule infectée.
L'acide nucléique viral se comporte dans la cellule comme un agresseur. Les informations codées dans l’ARN (ou l’ADN) viral constituent un « ordre » plus obligatoire et plus strict pour la cellule que les efforts de ses propres acides nucléiques pour maintenir l’activité physiologique normale du corps à un certain niveau. Pendant plusieurs heures et parfois plusieurs jours après l'infection, l'acide nucléique viral infecté dirige toutes les réserves de construction de la cellule capturée pour créer des centaines et des milliers de nouvelles particules virales.
La cellule se transforme en usine pour rassembler ses tueurs. Ce sont les tueurs, car la progéniture virale s’efforce de sortir et brise ou fait fondre la membrane cellulaire, provoquant la mort de la cellule hôte.
Le virus utilise les ressources de construction et les systèmes enzymatiques de la cellule pour ses besoins, puis la détruit afin d'infecter et, par conséquent, de détruire des centaines, voire des milliers de nouvelles cellules au stade suivant de l'infection.
Une fois que les cellules sont infectées par divers virus, une protéine spéciale se forme d'abord (les scientifiques l'appellent protéine inhibitrice), qui supprime le fonctionnement normal de l'ADN cellulaire. Il arrête la transmission des informations nécessaires aux processus de synthèse cellulaire normaux.
À peu près au même moment, une enzyme se forme qui brise les complexes polysomaux sur lesquels s'effectue l'assemblage des protéines cellulaires. Désormais, la cellule ne produit plus ses propres protéines. De plus, et c'est le plus important, l'enzyme polymérase (un autre nom est synthétase) est synthétisée, nécessaire à la fabrication de copies de l'ARN viral entré dans la cellule.
Pour le sort ultérieur du virus, c'est l'étape de formation de la polymérase qui est vitale, car des copies d'ARN seront utilisées pour remplir l'assemblage de nouveaux virions. Les ARN viraux spécifiques synthétisés dans la cellule servent également de modèles sur lesquels sont construites les parties protéiques du virion - ses capsomères.
On suppose que les molécules d'acide nucléique destinées aux futures particules virales sont construites dans le noyau de la cellule infectée et que les cellules protéiques sont construites dans le cytoplasme. Ensuite, la formation d’un virus « complet », c’est-à-dire mature, se produit. Sur la surface interne de la membrane cellulaire, l'union de l'acide nucléique viral (ARN ou ADN) avec la gaine protéique est achevée. Ce processus se produit simultanément dans de nombreux domaines et se termine par la maturation d’une grande masse de particules hautement infectieuses.
Parfois, les cellules produisent plus de molécules d’un biopolymère que d’un autre. Si un excès de protéines virales s'est formé dans une cellule infectée, ses molécules forment une coque virale qui n'est pas remplie d'ARN (ce qui n'était tout simplement pas suffisant pour cela). Ces structures, appelées virus « incomplets », émergent de la cellule et sont visibles au microscope électronique. Ils ressemblent à un beignet avec un trou au milieu. Naturellement, un virus aussi « incomplet » n'a pas de propriétés infectieuses, qui dépendent entièrement uniquement de l'ARN.
- Ainsi, les propriétés infectieuses du virus sont associées à son acide nucléique.
- Oui, et cela a été prouvé dans plusieurs des plus grands laboratoires du monde.
- Quel est le rôle des protéines ?
- Il protège l'acide nucléique des influences extérieures et aide le virus à pénétrer dans la cellule.
Il y a un quart de siècle, en 1952, les célèbres biochimistes américains E. Hershey et M. Chase, en étudiant les bactériophages, montraient pour la première fois que les acides nucléiques jouaient un rôle majeur dans la reproduction des virus. Contrairement à tous les autres virus, les bactériophages ne pénètrent pas dans la cellule de leur hôte, un microbe, mais s'attachent uniquement à sa coquille. En observant au microscope électronique les différentes étapes d’interaction entre bactériophages et bactéries, les scientifiques ont pu voir comment le phage introduit son acide nucléique dans le microbe. Toute la gaine protéique avec laquelle le bactériophage est attaché à la coquille du microbe reste à l'extérieur. Les photographies obtenues par les scientifiques ont fait le tour du monde, réfutant les affirmations précédentes sur le rôle prépondérant des protéines dans la transmission des informations héréditaires.
Mais tout ce qui concerne un bactériophage ne doit pas nécessairement être répété lors de la reproduction d'autres virus structurés différemment, affirmaient les sceptiques qui ne pouvaient pas comprendre qu'à partir d'une molécule d'ARN viral dans une cellule, un millier ou plus de nouveaux virus pourraient simultanément surgir. Et en 1956, H. Frenkel-Conrad aux États-Unis et en même temps A. Gierer et G. Schramm en Allemagne firent une découverte importante, pour laquelle ils reçurent plus tard le prix Nobel. En détruisant le composant protéique de la particule du virus de la mosaïque du tabac avec de l'acide carbolique fort (phénol), ils ont isolé l'ARN et l'ont purifié. L’ARN résultant ne contenait même pas de traces de protéines. Néanmoins, son introduction dans les feuilles de plantes saines a provoqué le développement d’une maladie typique de la mosaïque.

Le fait même d’isoler la composante infectieuse du virus (son acide nucléique) à l’aide de l’acide phénique, largement utilisé dans la désinfection pratique pour détruire les micro-organismes les plus résistants, semblait quelque chose d’incroyable. De plus, l'acide nucléique obtenu après avoir brûlé les molécules de protéines du virion avec du phénol a été précipité et stocké pendant une longue période dans de l'alcool pur, qui est également un puissant désinfectant. Malgré ces effets des plus nocifs, totalement incompatibles avec les conceptions de la vie qui existaient en médecine, l'acide nucléique viral a parfaitement conservé son caractère infectieux pour les cellules des plants de tabac sensibles.
Ces dernières années, des acides ribonucléiques aux propriétés infectieuses ont également été isolés de nombreux virus de petits animaux et humains (poliomyélite, encéphalite à tiques, virus provoquant une dégénérescence maligne des tissus). De tels ARN viraux ont été appelés infectieux car ils provoquaient le développement de maladies chez des animaux sensibles ou dans des cultures de tissus sensibles sans la participation de particules virales ou de leurs protéines. De plus, après chacune de ces infections artificielles à l'aide d'ARN infectieux, des particules virales à part entière sont apparues dans les cellules de l'objet étudié.
La découverte d’acides nucléiques infectieux a d’abord suscité l’incrédulité. De nombreux biologistes, même très respectables, pensaient que le processus infectieux n'était pas causé par les acides nucléiques eux-mêmes, mais par des particules d'un virus vivant ou des impuretés protéiques conservées en solution. Cependant, ces doutes ont été rapidement réfutés. X. Frenkel-Conrad a utilisé les méthodes d'analyse chimique les plus sensibles, capables de détecter même des molécules de protéines individuelles. Tous les tests protéiques étaient négatifs : les préparations ne contenaient que de l'acide nucléique.
Il fallait désormais prouver que c'était elle qui était infectieuse pour les plantes saines. À cette fin, A. Gierer et G. Schramm ont mené des études de contrôle spéciales, qui ont montré que l'ajout de l'enzyme ribonucléase à la préparation d'ARN viral détruisait complètement ses propriétés infectieuses. Cela a confirmé que tout pouvoir infectieux réside dans l'ARN examiné, puisque la rnbonucléase est totalement inoffensive pour la particule virale.
Les chercheurs ont également constaté que l’activité des acides nucléiques viraux ne changeait pas après l’ajout d’immunsérum. Si, après le traitement au phénol, même des particules virales individuelles non tuées restaient dans la préparation d'ARN viral, l'immunsérum supprimerait leur activité biologique.
Pour enfin prouver qu’ils avaient raison, les chercheurs ont procédé à des tests supplémentaires. Ils ont découvert que les préparations d’ARN viral purifié sont extrêmement instables et se dégradent rapidement même après un stockage à court terme dans un thermostat ou dans une glacière.
En revanche, les particules du virus original de la mosaïque du tabac sont restées très stables même après un stockage prolongé dans les mêmes conditions. Les scientifiques pensaient donc que les particules virales seraient faciles à détecter quelques jours après leur stockage sur le glacier, lorsque les acides nucléiques délicats seraient complètement détruits. Cependant, toutes les tentatives ont échoué : avec la mort de l’ARN, l’activité infectieuse du médicament purifié a disparu. Ainsi, il a finalement été prouvé que c’était l’ARN isolé du virus, et non le virus résiduel, qui provoquait l’infection des feuilles des plantes.
Les acides nucléiques viraux purifiés sont capables d'infecter même des tissus naturellement complètement immunisés, c'est-à-dire résistants, insensibles à l'ensemble du virus. Par exemple, le virus de la polio se reproduit bien dans les cultures de tissus préparées à partir de cellules humaines. Après tout, chez l’homme, ce virus provoque des lésions de la moelle épinière, la paralysie et la mort. Dans le même temps, ce virus n’est pas capable d’infecter les cultures de tissus préparées à partir de cellules de poulet, tout comme il ne peut pas infecter le poulet.
L'ARN infectieux isolé du virus de la polio a été facilement introduit dans les cellules de poulet, après quoi des centaines de particules virales matures à part entière s'y sont formées. Mais dans les tissus insensibles, l’infection virale s’est arrêtée là. Les nouveaux virions, qui pourraient être hautement infectieux pour les tissus sensibles, étaient souvent incapables de s'échapper des cellules qui leur étaient insensibles.
Cependant, à l’aide d’un microscope électronique, les scientifiques ont pu voir des particules virales à l’intérieur des cellules et isoler le virus des cellules en les détruisant par ultrasons. Un tel virus se multiplie bien s’il est transféré dans un autre tissu sensible.
Si l'on prend en compte le caractère complètement artificiel des expériences avec de l'acide nucléique viral purifié, à l'aide desquelles les scientifiques ont tenté d'infecter des plantes, des animaux ou des cultures de tissus, il devient clair pourquoi l'activité de l'ARN viral infectieux est incomparablement inférieure à l'activité du particules originales. Pour infecter une culture tissulaire, vous devez prélever de l'ARN isolé de 10 ^ 6 à 10 ^ 8 particules virales ou un total de 4 à 10 virions. La différence est énorme et les valeurs sont incomparables.
Dans des conditions naturelles, l’ARN nu ne pénètre jamais dans les cellules depuis l’extérieur, à travers la membrane cellulaire. Les acides nucléiques arrivent toujours ici uniquement dans le cadre d’une particule virale entière, qui libère de l’ARN (ou de l’ADN) viral uniquement à l’intérieur de la cellule infectée. Bien que les acides nucléiques viraux jouent un rôle de premier plan dans la reproduction des virus, ils n’ont pas la capacité de se déplacer indépendamment d’une cellule à l’autre.
- Comment le corps d'un animal ou d'une personne se protège-t-il d'un virus qu'il n'a jamais rencontré auparavant ?
En règle générale, la première étape se termine par la mort des cellules infectées. En conséquence, plusieurs milliers de nouveaux virus se forment, puis un million, un milliard, puis le corps doit mourir.
- Mais dans des conditions réelles, cela n'arrive pas. Le malade se rétablit généralement.
En effet, même dans les cas d’infections virales les plus graves, comme la variole ou l’encéphalite à tiques, toutes les personnes infectées ne meurent pas, et les maladies comme les oreillons, la rougeole et la grippe se terminent heureusement pour la majorité.
En se défendant contre les agents pathogènes des maladies infectieuses, le corps produit, comme on le sait, des substances protectrices très efficaces - les anticorps. Des anticorps se forment contre chaque agent pathogène, qu'il s'agisse d'une bactérie ou d'un virus. Ils se connectent uniquement à « leur » agent pathogène et neutralisent son activité, sans affecter du tout les autres.
Chaque étape du développement de toute science, y compris la médecine, correspond à un certain niveau de connaissances. Par conséquent, bon nombre des dispositions initiales, sortes d'axiomes de la virologie, reposaient sur les connaissances précédemment acquises par les microbiologistes qui étudiaient l'immunité antimicrobienne. C'est pourquoi les virologues ont longtemps cru que la guérison n'était assurée que par une immunité spécifique, ses anticorps, qui se forment en réponse à un virus pénétrant dans l'organisme et s'y multipliant. Il y avait cependant une certaine contradiction qu’ils ont longtemps essayé d’ignorer, même si elle était littéralement frappante.

Ce fait bien connu s’est avéré totalement incompréhensible : des anticorps se forment et pénètrent dans le sang quelques jours après l’infection. C’est exactement le temps nécessaire à l’organisme pour répondre à une agression et produire les quantités nécessaires d’anticorps protecteurs capables de se lier au virus. Mais, connaissant le taux inhabituellement élevé de reproduction du virus dans les cellules infectées, on peut facilement calculer qu'au cours des deux à trois premiers jours de la maladie, d'innombrables hordes de nouveaux virus devraient se former. Par conséquent, les anticorps seront tout simplement en retard et ne pourront pas neutraliser l’infection !
De plus, les scientifiques ont montré que les anticorps n'agissent que lorsque le virus se trouve en dehors de la cellule : dans le sang, dans la lymphe, et ne sont pas capables de pénétrer dans les cellules infectées par le virus, bien qu'ils empêchent l'introduction des virus dans les tissus sensibles.
Évidemment, il existe des méthodes de protection encore inconnues qui, dans les premières heures suivant l'infection, devraient d'abord limiter la reproduction du virus à l'intérieur de la cellule, puis empêcher l'infection de nouvelles cellules, comme si l'on attachait les mains et les pieds du virus avant l'armée principale s'approche de la protection - les anticorps.
On pourrait penser que dès les tout premiers stades de l'évolution des êtres vivants à la surface de notre planète, une lutte inégale a commencé entre les organismes cellulaires et leurs plus petits ennemis - les virus. Compte tenu du taux de reproduction inhabituellement rapide du virus, une telle lutte aurait dû se terminer par une victoire incontestable sur des organismes multicellulaires organisés de manière plus complexe. Afin de se protéger d’une manière ou d’une autre des ennemis à reproduction rapide, les vertébrés ont développé il y a plusieurs milliers d’années un mécanisme universel de défense contre l’agression virale. Cette protection supplémentaire (mais peut-être la principale) contre l’infection virale se manifeste et agit au niveau cellulaire. Il supprime fortement le taux de reproduction des virus et ralentit le taux de développement du processus infectieux.
Au milieu des années 30, deux chercheurs américains, G. Findlay et F. McCallum, ont mené des expériences sur des singes, étudiant les variétés de virus de la fièvre jaune qui ont provoqué ou non le développement d'une encéphalite chez ces animaux. Les virus étaient souvent la cause de décès chez les personnes vivant en Afrique, et notamment chez les Européens venus sur le continent africain : voyageurs, marins et colons. Les singes, tout comme les humains, sont morts de ces virus et ont souvent développé une grave paralysie.
Un jour, ne disposant pas d'un nombre suffisant de singes, des scientifiques ont infecté des animaux avec un virus mortel auquel on avait injecté une version atténuée du virus de la fièvre jaune quelques jours plus tôt. Un phénomène incompréhensible et véritablement miraculeux s'est produit : non seulement les singes ne sont pas morts, mais ils ne sont même pas tombés malades. Les expériences se sont succédées et les résultats, se répétant les uns les autres, nous ont permis de conclure qu'une toute nouvelle opportunité avait été trouvée pour sauver les animaux des virus mortels. Pour ce faire, il faut leur injecter peu de temps avant l’infection par un autre virus peu dangereux, qui peut même être un virus d’un type complètement différent.
Ainsi, une découverte majeure a été faite et un nouveau terme « interférence » de virus est apparu en médecine, dérivé du mot anglais « interférence », « obstacle ».
Dès le début de ces travaux, il était clair pour les scientifiques que la nature de l'interférence n'était pas du tout associée à l'immunité, mais à un mécanisme « non spécifique ». Pourtant, pendant 20 longues années, les scientifiques attribuaient l’effet protecteur à une simple compétition entre deux rivaux. Ils pensaient que le premier virus « non mortel » enlevait au deuxième virus « malin » les ressources nutritionnelles de l’organisme infecté, ce qui était confirmé par la mauvaise reproduction du virus mortel introduit en second lieu.
En 1957, le scientifique anglais A. Isaacs et son jeune stagiaire, le Dr D. Lindenman, montrèrent que la raison de l'interférence était complètement différente. Les chercheurs ont étudié l’absorption du virus dans les cellules à partir du milieu de culture environnant et s’attendaient à constater une diminution de la force d’interférence du milieu. Cependant, c’est le contraire qui s’est produit. Mais les scientifiques, heureusement, n’ont pas ignoré ce fait initialement incompréhensible, mais ont commencé à chercher la raison qui l’avait provoqué. Ils ont découvert que si un virus de la grippe inactivé par la chaleur est introduit dans une culture tissulaire, les cellules infectées commencent à produire une sorte de substance protéique et à la libérer dans l'environnement. Il n’a pas été possible de détecter une telle protéine dans des cellules non infectées.
Isaacs a appelé la protéine qu'il a découverte interféron et a ainsi immortalisé son nom.
L'interféron possédait les propriétés miraculeuses d'un médicament antiviral idéal et sa découverte fut un événement majeur en biologie et en médecine. Certes, au début, cela a suscité la méfiance, mais après deux ou trois ans, cela a provoqué un large flux de recherches dans tous les pays du monde. Les scientifiques ont tenté de découvrir la nature de l'interféron, de comprendre le mécanisme de son action sur les virus et de l'utiliser pour lutter contre les maladies virales chez l'homme et les animaux.
Les molécules d'interféron sont dotées de propriétés très importantes et intéressantes : elles sont totalement dépourvues de tout effet secondaire sur l'organisme. La protection contre les virus n'est observée que dans les cellules des espèces animales qui ont produit de l'interféron. Contrairement aux anticorps, il supprime la reproduction de presque tous les virus connus. L'activité des meilleurs antibiotiques (streptomycine, pénicilline, érythromycine et autres) s'étend à de nombreux agents pathogènes bactériens, mais malheureusement pas aux virus.
Comme il est désormais établi, dans les premiers jours suivant l'infection, c'est l'interféron qui protège l'organisme des effets mortels de tout virus. Ceci est très important dans les cas où le corps rencontre un virus pour la première fois de sa vie et ne possède pas d'anticorps contre celui-ci. Interféron joue le rôle d’un avant-poste frontalier, qui prend en charge l’attaque ennemie jusqu’à l’arrivée des principales troupes défensives.
Ceci est particulièrement utile pour les infections telles que la grippe et le rhume, qui ne durent que trois à cinq jours. C'est ensuite l'interféron qui favorise la récupération, puisque les anticorps se forment tardivement, n'ont pas le temps d'influencer le virus et ne jouent leur rôle protecteur que lorsque l'organisme rencontre à nouveau le même virus.
Peu de temps après que le virus s’est attaché à la surface des cellules, celles-ci « reconnaissent » son visage non seulement comme une protéine nutritionnelle utile, mais aussi comme son ennemi mortel. C’est cette « reconnaissance » précoce qui permet à l’organisme de préparer rapidement une défense efficace pour supprimer une infection virale ou du moins la limiter dans les premières heures qui suivent le début de la maladie.
L'étude des processus les plus subtils se produisant au niveau moléculaire à l'intérieur des cellules vivantes a pris beaucoup de temps. Et si l'interféron était découvert en Angleterre, il était alors possible d'expliquer comment il se forme en Amérique.
Le virologue S. Baron de l'Institut des allergies et des maladies infectieuses, situé à Bethesda,
près de Washington, a consacré de nombreuses années à étudier seulement deux questions : pourquoi l'interféron se forme-t-il dans les cellules infectées par un virus et comment cela se produit-il ? Pensez-y! Juste deux questions, mais tellement importantes ! Si vous y répondez, la voie s'ouvrira pour comprendre la tâche principale : un moyen de lutter contre toute infection virale.
Le scientifique a pu établir que dès que le virus pénètre dans le cytoplasme de la cellule et commence à s'y « déshabiller », se débarrassant de sa couverture protéique et libérant de l'acide nucléique, la cellule perçoit ces actions comme un signal d'alarme, signalant l'invasion de un ennemi mortel, contre lequel il faut immédiatement préparer les armes les plus actives.
S. Baron a également prouvé que le début de la synthèse de l'interféron coïncide avec la période où, dans une cellule infectée, l'ARN viral devient la matrice à partir de laquelle sont imprimés de nouveaux ARN. Les ARN double brin formés au cours de ce processus stimulent la formation d’interféron. Et cela se produit parce que dans les cellules saines, il n’y a jamais d’ARN double brin, mais uniquement des ARN simple brin. La forme double brin de l’ARN est étrangère à la cellule, et c’est exactement ce qu’il faut pour envoyer un signal de danger. C'était la réponse à la question « pourquoi ».
La réponse à la deuxième question – « comment » – a pris beaucoup plus de temps. Il s'est avéré que lorsqu'une cellule reçoit un signal de danger, un gène opérateur spécial s'active immédiatement. La synthèse de l'ARN messager commence, puis sur sa matrice dans les polysomes de la cellule, des molécules protéiques relativement simples et légères, que l'on appelle interféron, sont assemblées. En 1974, des scientifiques ont découvert que l'ADN responsable de la formation de l'interféron se situe chez l'homme uniquement sur les chromosomes n°2 et 5.
La période de formation de plusieurs milliers de molécules d'interféron dans une cellule infectée prend généralement de deux à six heures. Cela signifie qu’elle est beaucoup plus courte que la période de reproduction de la progéniture virale. Et si c’est le cas, la cellule parvient à devancer l’agresseur et à construire une arme avant que la masse des virus nés ne sorte et n’attaque de nouvelles cellules encore sans défense.
La petite molécule d’interféron peut facilement traverser les membranes cellulaires. Pendant que le virus se multiplie dans la cellule infectée, l'interféron a déjà réussi à se former, à sortir de cette cellule infectée dans le sang, la lymphe, dans l'espace environnant et à pénétrer dans d'autres cellules.
Bien que de nombreux groupes de cellules du tissu conjonctif et épithélial soient capables de synthétiser l'interféron, les globules blancs (lymphocytes) effectuent ce travail particulièrement activement.
Le fondateur de la chimiothérapie contre les infections microbiennes, le bactériologiste allemand P. Ehrlich, rêvait autrefois de synthétiser des composés chimiques capables de guérir toutes les maladies infectieuses sans nuire aux patients. L'interféron est sans aucun doute le premier médicament idéal de ce type.
Même les meilleurs antibiotiques ne peuvent rivaliser avec l'interféron en termes de gravité de leur effet thérapeutique. Les chercheurs ont calculé que pour traiter une grippe grave, il suffit d'administrer au patient un seul milligramme d'interféron pur en plusieurs doses. En règle générale, pour traiter les maladies infectieuses bactériennes, plusieurs grammes de l'un ou l'autre antibiotique sont utilisés quotidiennement.
Comment l’interféron agit-il sur le virus ? Peut-il se lier au virus et le neutraliser, comme le font les anticorps ?
- Non, l'interféron ne se combine pas avec le virus, et c'est l'une de ses différences décisives avec les anticorps.
Mais peut-être que l'interféron empêche le virus de s'adsorber sur la membrane cellulaire, ou l'empêche d'une manière ou d'une autre de pénétrer dans la cellule, ou, agissant sur l'acide nucléique viral, l'inactive ?
Ici, vous êtes un peu plus proche de la vérité. Les gens essaient souvent de trouver des analogies déjà connues pour expliquer ce qui est nouveau et incompréhensible. Cela s'est produit avec l'interféron, dont l'effet sur les virus est tout à fait inhabituel.
De nombreux scientifiques du monde entier ont découvert que l'interféron est doté d'un « spectre » d'activité antivirale inhabituellement large : il supprime la reproduction de la plupart des virus connus. Empêche la prolifération du virus de la variole dans la peau, du virus de la grippe dans les poumons, du virus de l'encéphalite dans le cerveau, du virus de la leucémie dans la moelle osseuse ou dans les leucocytes sanguins.
Les premières recherches ont déjà établi que l'interféron n'avait pas d'effet direct sur le virus. En effet, ils ont tenté de combiner une suspension virale avec des préparations concentrées d'interféron dans un tube à essai, puis d'infecter un animal avec ce mélange. Et nous étions convaincus que le processus infectieux se développe avec la même intensité que lors de l'utilisation d'un virus sans interféron.
Le mécanisme d'action de l'interféron a été déchiffré assez récemment. Et cela a été fait par le virologue américain S. Baron et nos scientifiques soviétiques, les Moscovites F. Ershov et V. Zhdanov de l'Institut de virologie D. Ivanovsky. Ils ont prouvé que l'ensemble du processus de protection du corps contre un virus envahisseur se déroule à l'intérieur de cellules non infectées et, en 1975, un groupe de scientifiques de l'Université de Yale (États-Unis) a établi que dans les noyaux des cellules humaines, dans le chromosome n° 21, il existe un groupe spécial de gènes (une section spécifique de l'ADN, à laquelle la molécule d'interféron se connecte dès qu'elle pénètre dans la cellule), responsable de ce processus.
Une petite molécule d'interféron est capable de traverser librement les membranes cellulaires et, en pénétrant dans le cytoplasme, d'influencer l'appareil synthétique de la cellule afin qu'elle devienne impropre à la reproduction des virus. Ce mécanisme est fondamentalement différent de l’action des anticorps qui, pour remplir leur fonction, doivent nécessairement se combiner avec des virus situés à l’extérieur de la cellule. Ce n’est qu’ainsi que les anticorps empêchent le virus de passer d’une cellule infectée à une cellule saine.
Malheureusement, les processus se produisant au niveau de molécules aussi petites que l’interféron ne peuvent pas être observés. Mais les méthodes les plus sophistiquées de la virologie et de la génétique modernes permettent de suivre indirectement l’évolution de ces processus.
V. Zhdanov, F. Ershov et leurs collaborateurs ont découvert que l'interféron, pour ainsi dire, réveille de l'hibernation un groupe de gènes responsables de la synthèse d'ARN messagers spéciaux, à l'aide desquels la cellule construit rapidement une protéine antivirale. Puis les événements se déroulent d’une manière tout à fait inhabituelle. La protéine antivirale nouvellement synthétisée est utilisée par la cellule non pas pour neutraliser le virus lui-même, mais pour perturber le mécanisme intelligemment établi d'impression de copies de l'ARN viral et rendre impossible la reproduction d'une progéniture virale. Tous les processus de synthèse nécessaires au fonctionnement normal de la cellule elle-même sont préservés.
Chaque molécule de protéine antivirale s'attache à l'un des ribosomes, modifiant ainsi légèrement sa configuration. Ces ribosomes conservent toujours la capacité de se combiner sous l'influence d'ARN messagers en complexes polygames et de construire de nouvelles protéines cellulaires. Cependant, si un polysome se forme sous l'influence de l'ARN messager viral, il n'y aura alors plus de transmission d'informations et la synthèse de protéines virales n'aura pas lieu.
De nombreux scientifiques ont parlé du rôle protecteur prédominant de l'interféron dans des infections aiguës et à court terme comme la grippe. À l'Institut de recherche en épidémiologie et microbiologie L. Pasteur, ils ont examiné un grand nombre de sérums sanguins de personnes grippées et soignées à l'hôpital S. Botkin de Leningrad. Il s'est avéré que plus l'interféron se formait dans les premiers jours de la maladie, plus la grippe était bénigne et plus le patient se rétablissait rapidement. Chez certaines personnes, l'interféron a complètement empêché le développement de la maladie, bien qu'il y ait eu une infection latente confirmée par la formation d'anticorps.
L'effet bénéfique de l'interféron dépend du degré de pathogénicité, de la nocivité du virus pour l'organisme, ainsi que de l'état général de la santé humaine. L'effet protecteur de l'interféron est réduit si l'agent causal de l'infection virale est excessif, destructeur, toxique et si la personne est affaiblie par le surmenage, le stress nerveux, les maladies chroniques du cœur, du foie et des poumons.
Lorsque le système d'interféron ne fonctionnait pas, la grippe devenait mortelle pour le patient. C'est exactement ce qu'a prouvé le célèbre scientifique anglais D. Tyrrell en examinant un grand nombre de personnes pour qui la grippe est devenue la cause du décès. Tous sont morts dans les premiers jours de la grippe. Chez aucune de ces personnes, il n’a été possible de détecter l’interféron ni dans les poumons ni dans le sang.
À l'inverse, nous pouvons supposer que le succès d'une infection virale est le résultat de l'activité défensive active des cellules infectées qui produisent de l'interféron, ce qui perturbe la synthèse de nouvelles particules virales et élimine le risque d'émergence et de propagation de nouvelles générations de virus. virus dans tout le corps.
Les scientifiques ont non seulement prouvé que l'un des facteurs déterminant la résistance de l'organisme aux infections virales est sa capacité à produire de l'interféron, mais aussi que celle-ci varie d'une personne à l'autre. Les caractéristiques innées du corps jouent un rôle majeur. Environ un tiers de la population présente des traits héréditaires caractéristiques qui rendent leur corps incapable de produire de l'interféron. Cette capacité dépend aussi de l'âge : l'interféron est produit plus faiblement chez les enfants de moins de deux ans, ainsi que chez les personnes âgées de plus de 60 à 65 ans.
La formation d'interféron se produit différemment selon les conditions extérieures, par exemple la météo, la température de l'air et la période de l'année. En hiver ou en automne, l’organisme produit de l’interféron plus lentement et en moindre quantité que par temps chaud. Par conséquent, en été, les gens sont beaucoup moins susceptibles de souffrir de la grippe et d'autres maladies des voies respiratoires supérieures.
Ainsi, la première ligne de la lutte contre les virus se situe à l’intérieur des cellules vivantes. Le chemin pour le comprendre est très difficile et long. Les chercheurs n’en sont qu’au tout début. Cependant, de nouveaux faits que l'humanité a récemment maîtrisés ont aidé à résoudre le mystère peut-être le plus difficile : le mécanisme universel à l'aide duquel la nature a aidé toutes les créatures vivant sur terre à vaincre les virus.
- Théoriquement, tout semble clair. Mais comment préparer beaucoup d’interféron ?
- A cet effet, les méthodes nécessaires ont déjà été développées en laboratoire.
- Pourtant, il est encore plus intéressant de maîtriser le secret de démarrage de la « machine » qui produit l'interféron dans l'organisme !
- Je suis d'accord : c'est le chemin vers la victoire sur les virus.
Avec la découverte de l’interféron, de nouvelles perspectives sont apparues dans la lutte contre les infections virales. Il a commencé à être considéré non seulement comme un complément précieux aux moyens anciens et éprouvés de prévention des maladies virales (vaccins vivants ou tués), mais également comme un agent thérapeutique ou prophylactique indépendant. Une perspective très tentante s’est ouverte pour créer des médicaments pouvant être utilisés pour augmenter l’immunité naturelle du corps contre les infections virales.
Il existe deux manières d’utiliser pratiquement l’interféron pour la prévention ou le traitement des maladies virales. Vous pouvez administrer aux personnes une préparation prête à l'emploi d'interféron hautement actif, fabriquée en laboratoire ou dans une usine biologique spéciale. Cependant, l’interféron introduit de l’extérieur est rapidement détruit. Par conséquent, afin de maintenir sa concentration à un niveau approprié, l’interféron doit être administré toutes les trois à quatre heures. En cas de maladie grave, de telles tactiques sont justifiées. Comment utiliser l’interféron à des fins de prévention ? Après tout, il est particulièrement efficace dans les premières heures suivant l’introduction du virus, lorsqu’il commence tout juste à se multiplier. Cependant, il est très difficile de deviner ce moment, et le plus souvent c'est complètement impossible.
De plus, il est possible de forcer le corps humain à produire de l'interféron à l'aide de virus bénins et inoffensifs ou de certaines substances synthétiques. L'interféron qu'ils donnent vie luttera sur plusieurs fronts à la fois contre les agents responsables de toutes les maladies virales, quelle que soit leur forme.

Les scientifiques ont découvert que pour avoir un effet sur une infection virale telle que la grippe, il est nécessaire qu'une préparation d'interféron contienne au moins 500 000 unités internationales dans un millilitre du médicament. La production de produits aussi hautement actifs a commencé il y a plusieurs années en Finlande, au Japon et dans notre pays. Les globules blancs, les leucocytes humains, isolés selon des méthodes spéciales à partir du sang de donneurs, sont utilisés comme matières premières.
Les donneurs sont les personnes sans lesquelles il est impossible de préparer une quantité suffisamment importante d’interféron. En donnant leur sang gratuitement ou contre rémunération, les donneurs aident non seulement les patients qui ont besoin d'une transfusion de sang humain frais après un accident de la route, une maladie grave ou une intervention chirurgicale, mais contribuent également à la préparation d'une substance médicinale précieuse, l'action de qui vise à lutter contre les maladies virales.
Les leucocytes isolés du sang des donneurs sont infectés par un virus parainfluenza de souris inoffensif pour l'homme (appelé virus Sendai du nom de la ville japonaise où il a été isolé). Les cellules commencent à produire intensément de l'interféron et après 15 à 18 heures, des quantités importantes s'accumulent dans le milieu nutritif entourant les leucocytes.
Grâce à une série de procédures très laborieuses et très précises, tous les globules blancs et protéines contaminantes nocives pour le corps humain sont éliminés du liquide. Le médicament est purifié à l’aide de colonnes avec des résines spéciales qui laissent passer l’interféron mais retiennent les produits de ballast nocifs.
Jusqu’à présent, la production véritablement massive d’interféron a été entravée par le manque de sang humain frais. Il est donc très important que le nombre de donneurs augmente afin qu'un nombre suffisamment grand de leucocytes puisse être obtenu pour produire de l'interféron.
L'un des plus grands passionnés de l'obtention d'interféron leucocytaire était le virologue finlandais K Kantel. Il commença ce travail en 1963 et organisa dix ans plus tard la production massive en Finlande d'un médicament doté d'une activité exceptionnellement élevée : chaque milligramme contenait de un à dix millions d'unités d'interféron. Grâce à ce médicament, les patients souffrant d'herpès oculaire et d'hépatite chronique ont été guéris. Mais le plus grand succès a été obtenu lorsqu'il a été possible de prévenir le développement de métastases chez plusieurs patients atteints d'un sarcome osseux mortel. Des expériences ont également commencé sur le traitement des patients atteints de leucémie (cancer du sang), de cancer du col de l'utérus et d'autres tumeurs malignes. En 1981, les premiers résultats ont été obtenus, démontrant de manière convaincante que le cancer et le sarcome peuvent être guéris chez une proportion significative de patients si le traitement par interféron est commencé le plus tôt possible. Certes, le traitement prend beaucoup de temps et nécessite beaucoup d'interféron hautement actif : l'interféron obtenu à partir du sang de 200 à 300 donneurs a été utilisé pour un patient.
Il fallait une autre source d'interféron, moins chère et en quantité non limitée, comme les leucocytes provenant du sang de donneurs humains. Au début, ils ont essayé d'utiliser à ces fins des cultures de cellules vivantes, qui pouvaient être multipliées en continu en laboratoire.
De telles cellules ont été trouvées et peuvent être réensemencées jusqu'à 40 à 60 fois ou plus. Tous les deux ou trois jours, au cours du processus de division, leur nombre augmente plusieurs fois. Les cellules sont ensemencées encore et encore, elles sont exposées à un virus qui produit de l'interféron, puis la récolte requise de matières premières finies est collectée.
Pour ce faire, ils utilisent plusieurs cultures cellulaires, mais le médicament est trop cher ou contient un mélange de virus responsables de tumeurs, dont ils n'ont pas encore appris à se débarrasser.
La réalisation la plus intéressante de ces dernières années a été la méthode de génie génétique, basée sur la possibilité d'obtenir, dans des conditions artificielles, des copies exactes du gène qui régule la synthèse de l'interféron dans les leucocytes.
En bref, ce processus est le suivant : premièrement, le processus de synthèse de l'interféron est « démarré » dans une suspension de leucocytes du donneur. Lorsqu'un grand nombre d'ARN messagers se sont accumulés dans les cellules, qui, comme nous le savons déjà, sont une empreinte miroir du gène de l'interféron et en même temps la matrice sur laquelle les molécules d'interféron seront « construites » dans le leucocyte, ils sont extrait et retiré des leucocytes. Ensuite, grâce à des processus biochimiques très complexes, est synthétisé l’ADN, qui est une copie miroir de ces ARN, et donc une copie exacte du gène de l’interféron.
Maintenant que le gène a été obtenu, nous devons le faire fonctionner. L'attention des scientifiques s'est concentrée sur une cellule microbienne - E. coli ordinaire. Toute la difficulté était de « introduire » ce gène insignifiant dans le corps du microbe et même de le faire fonctionner. Ensemble, les virologues de Leningrad de l'Institut Pasteur et les chercheurs lettons de l'Institut de synthèse organique de l'Académie des sciences de Lettonie et de l'Institut de microbiologie A. Kirchenstein de Riga ont accompli cette tâche.
À l'aide d'enzymes spéciales, il est désormais possible de « couper » l'ADN des chromosomes de la cellule à presque n'importe quel endroit souhaité, puis, à l'aide d'autres enzymes, d'y coller un fragment d'ADN artificiel obtenu en laboratoire, dans ce cas le gène de l’interféron. C'est ainsi qu'ont été obtenus E. coli, dans la substance héréditaire de laquelle il a été possible d'insérer un gène responsable de la synthèse de l'interféron humain. Ces microbes peuvent vivre et se multiplier dans des conditions artificielles, produisant de l'interféron humain, si nécessaire à notre médecine.
Il y a environ 10 ans, les virologues soviétiques ont décidé de trouver un moyen de forcer l'organisme à s'approvisionner en interféron. Les premières recherches ont conduit au monde des virus utiles. En effet, parmi les virus saprophytes, il y a ceux qui coexistent pacifiquement avec une personne, se trouvent constamment à l'intérieur de son corps, dans ses organes et tissus, sans provoquer de maladies.
Des scientifiques moscovites, dirigés par M. Vorochilova, membre correspondant de l'Académie des sciences médicales de l'URSS, se sont souvenus des soi-disant eitérovirus, qui vivent dans les intestins d'un enfant dès sa naissance et disparaissent ensuite. Les scientifiques pensaient que les entérovirus devraient jouer un rôle protecteur spécifique dans les premières années de la vie, lorsque l'enfant n'a pas encore eu le temps de se préparer à affronter divers virus et que son immunité est faible. Et si les entérovirus stimulaient la formation d'interféron dans le corps des nouveau-nés ? - pensaient les chercheurs. Pour tester cette hypothèse, ils ont créé un vaccin à base d'entérovirus saprophytes inoffensifs.
Lorsque le vaccin était administré par voie orale, les entérovirus s'installaient dans les intestins humains et s'y multipliaient pendant plusieurs semaines. Pendant tout ce temps, ils ont forcé le corps à produire de l'interféron. Désormais, il n'était plus effrayant que l'interféron soit rapidement détruit. De plus en plus de portions pénétraient dans la circulation sanguine. Et même si le corps le produit, la personne reste protégée contre une grande variété de maladies virales.
Au cours de plusieurs épidémies de grippe, le vaccin contre l’entérovirus a été utilisé avec succès dans de nombreuses villes du pays. Les scientifiques ont calculé que plusieurs milliers de personnes ayant reçu le vaccin stimulateur d'interféron n'ont pas contracté la grippe. Ceux qui ont été infectés étaient facilement malades et se rétablissaient rapidement.
Pour stimuler la production d'interféron dans le corps humain, d'autres vaccins viraux vivants sont utilisés avec succès : contre la grippe ou la rougeole, la polio ou les oreillons. Ces vaccins sont inoffensifs pour le corps humain, et en même temps, la reproduction des virus qu'ils contiennent s'accompagne de la formation de concentrations très élevées d'interféron. Après avoir administré un tel vaccin, une personne devient immunisée contre la grippe et d'autres maladies respiratoires pendant plusieurs jours, voire plusieurs semaines.
Des travaux menés à Leningrad lors d'épidémies de grippe ont montré que les stimulants à base d'interféron (également appelés inducteurs) réduisent de près de trois fois le nombre d'enfants contractant la grippe et d'autres rhumes.
En outre, les scientifiques ont créé plusieurs drogues synthétiques qui sont actuellement étudiées dans des conditions expérimentales. Des préparations de polysaccharides ont également été obtenues à partir de certains microbes et champignons, notamment de la levure ordinaire, avec lesquels nous cuisons le pain.
Ces médicaments sont également capables de stimuler la formation d'une protéine protectrice - l'interféron. Sous l'influence de tels inducteurs, le corps animal, se protégeant de manière fiable contre l'infection par divers virus, produit des milliers de fois plus d'interféron que ce qui peut être administré de manière externe sous la forme d'un médicament fini.
Les scientifiques ont jusqu'à présent réussi à ce que la production d'interféron dans le corps se poursuive pendant plusieurs jours. Malheureusement, une nouvelle stimulation est alors nécessaire.
Une étude des différentes propriétés des inducteurs d'interféron a montré que ces médicaments n'ont pas d'effet nocif sur l'organisme et peuvent être administrés pendant une longue période sans crainte de réactions indésirables. En règle générale, la protection est créée dès les premières heures. Il possède un spectre d’activité très large destiné à la grande majorité des virus actuellement connus.
Cette méthode d'utilisation des inducteurs d'interféron peut devenir particulièrement prometteuse en cas d'épidémies et de pandémies causées par de nouvelles variantes du virus de la grippe difficiles à répondre à la vaccination. Les observations limitées disponibles jusqu’à présent indiquent que, comme la vaccination, la prophylaxie par interféron réduit l’incidence de la maladie de deux à trois fois. De plus, l'utilisation d'interféron et de stimulateurs de sa formation peut protéger de la manière la plus fiable une personne confrontée à un nouveau virus.