Structure et fonctions des canaux ioniques. Les ions Na + , K + , Ca 2+ , Cl - pénètrent dans la cellule et sortent par des canaux spéciaux remplis de liquide. La taille des canaux est assez petite (diamètre 0,5-0,7 nm). Les calculs montrent que la surface totale des canaux occupe une partie insignifiante de la surface de la membrane cellulaire.
La fonction des canaux ioniques est étudiée de différentes manières. La plus courante est la méthode de pince de tension, ou « pince de tension » (Fig. 2.2). L'essence de la méthode est qu'à l'aide de systèmes électroniques spéciaux, le potentiel de membrane est modifié et fixé à un certain niveau au cours de l'expérience. Dans ce cas, l'ampleur du courant ionique circulant à travers la membrane est mesurée. Si la différence de potentiel est constante, alors, conformément à la loi d'Ohm, l'amplitude du courant est proportionnelle à la conductivité des canaux ioniques. En réponse à une dépolarisation progressive, certains canaux s'ouvrent et les ions correspondants pénètrent dans la cellule selon un gradient électrochimique, c'est-à-dire qu'un courant ionique apparaît qui dépolarise la cellule. Ce changement est détecté par un amplificateur de commande et un courant électrique traverse la membrane, d'amplitude égale mais de direction opposée au courant ionique de la membrane. Dans ce cas, la différence de potentiel transmembranaire ne change pas. L'utilisation combinée de pinces de tension et de bloqueurs de canaux ioniques spécifiques a conduit à la découverte de différents types de canaux ioniques dans la membrane cellulaire.
Actuellement, de nombreux types de canaux pour divers ions ont été installés (tableau 2.1). Certains d’entre eux sont très spécifiques, tandis que d’autres, en plus de l’ion principal, peuvent laisser passer d’autres ions.
L'étude de la fonction de canaux individuels est possible en utilisant la méthode de fixation locale du potentiel « path-clamp » ; riz. 2.3,A). Une microélectrode en verre (micropipette) est remplie de solution saline, pressée contre la surface de la membrane et un léger vide est créé. Dans ce cas, une partie de la membrane est aspirée vers la microélectrode. Si un canal ionique apparaît dans la zone d'aspiration, alors l'activité d'un seul canal est enregistrée. Le système d'irritation et d'enregistrement de l'activité des canaux diffère peu du système d'enregistrement de tension.
Tableau 2.1. Les canaux ioniques et courants ioniques les plus importants des cellules excitables
Note. THÉ - tétraéthylammonium; TTX - tétrodotoxine.
La partie externe du canal est relativement accessible à l'étude ; l'étude de la partie interne présente des difficultés importantes. P. G. Kostyuk a développé une méthode de dialyse intracellulaire qui permet d'étudier la fonction des structures d'entrée et de sortie des canaux ioniques sans utiliser de microélectrodes. Il s'est avéré que la partie du canal ionique ouverte sur l'espace extracellulaire diffère par ses propriétés fonctionnelles de la partie du canal faisant face à l'environnement intracellulaire.
Ce sont les canaux ioniques qui confèrent deux propriétés importantes à la membrane : la sélectivité et la conductivité.
Sélectivité ou la sélectivité, Ce canal est assuré par sa structure protéique particulière. La plupart des canaux sont contrôlés électriquement, c'est-à-dire que leur capacité à conduire les ions dépend de l'ampleur du potentiel membranaire. Le canal est hétérogène dans ses caractéristiques fonctionnelles, notamment en ce qui concerne les structures protéiques situées à l'entrée du canal et à sa sortie (les mécanismes dits de porte).
5. Le concept d'excitabilité. Paramètres d'excitabilité du système neuromusculaire : seuil d'irritation (rhéobase), temps utile (chronaxie). Dépendance de la force de l'irritation sur le temps de son action (courbe de Goorweg-Weiss). Résistance.
Excitabilité– la capacité d'une cellule à répondre à une irritation en formant un potentiel d'action et une réaction spécifique.
1) phase de réponse locale – dépolarisation partielle de la membrane (entrée de Na + dans la cellule). Si vous appliquez un petit stimulus, la réponse est plus forte.
La dépolarisation locale est la phase d'exaltation.
2) phase de caractère réfractaire absolu - la propriété des tissus excitables de ne pas former de PA sous quelque force de stimulus que ce soit
3) phase de caractère réfractaire relatif.
4) phase de repolarisation lente - irritation - encore une fois une réponse forte
5) phase d'hyperpolarisation – l'excitabilité est moindre (inférieure à la normale), le stimulus doit être important.
Labilité fonctionnelle– évaluation de l'excitabilité des tissus à travers le nombre maximum possible de PA par unité de temps.
Lois d'excitation :
1) la loi de la force - la force du stimulus doit être seuil ou supra-seuil (la quantité minimale de force qui provoque l'excitation). Plus le stimulus est fort, plus l'excitation est forte - uniquement pour les associations tissulaires (tronc nerveux, muscle, exception - SMC).
2) la loi du temps - la durée du stimulus actuel doit être suffisante pour l'apparition de l'excitation.
Il existe une relation inversement proportionnelle entre la force et le temps dans les limites entre le temps minimum et la force minimale. La force minimale - la rhéobase - est une force qui provoque une excitation et ne dépend pas de la durée. Le temps minimum est le temps utile. La chronaxie est l'excitabilité d'un tissu particulier ; le moment auquel l'excitation se produit est égal à deux rhéobases.
Plus la force est grande, plus la réponse est importante jusqu'à une certaine valeur.
Facteurs créant le MPP :
1) différence de concentrations de sodium et de potassium
2) perméabilité différente pour le sodium et le potassium
3) fonctionnement de la pompe Na-K (3 Na+ sont retirés, 2 K+ sont restitués).
La relation entre la force du stimulus et la durée de son impact, nécessaire à l'apparition d'une réponse minimale d'une structure vivante, peut être très clairement tracée sur la courbe dite force-temps (courbe de Goorweg-Weiss-Lapik) .
De l'analyse de la courbe il résulte que, quelle que soit la force du stimulus, si la durée de son influence est insuffisante, il n'y aura pas de réponse (le point à gauche de la branche ascendante de l'hyperbole). Un phénomène similaire est observé lors d’une exposition prolongée à des stimuli inférieurs au seuil. Le courant (ou tension) minimum capable de provoquer une excitation est appelé rhéobase par Lapik (segment d'ordonnée OA). La période de temps la plus courte pendant laquelle un courant égal à deux fois la rhéobase provoque une excitation dans le tissu est appelée chronaxie (segment d'abscisse OF), qui est un indicateur de la durée seuil d'irritation. La chronaxie se mesure en δ (millièmes de seconde). L'ampleur de la chronaxie peut être utilisée pour juger de la vitesse à laquelle l'excitation se produit dans le tissu : plus la chronaxie est petite, plus l'excitation se produit rapidement. La chronaxie des fibres nerveuses et musculaires humaines est égale aux millièmes et dix millièmes de seconde, et la chronaxie des tissus dits lents, par exemple les fibres musculaires de l'estomac d'une grenouille, est des centièmes de seconde.
La détermination de la chronaxie des tissus excitables s'est répandue non seulement expérimentalement, mais aussi en physiologie du sport et en clinique. En particulier, en mesurant la chronaxie musculaire, un neurologue peut déterminer la présence de lésions du nerf moteur. Il convient de noter que le stimulus peut être assez fort, avoir une durée seuil, mais un faible taux d'augmentation dans le temps jusqu'à la valeur seuil ; dans ce cas, l'excitation ne se produit pas. L’adaptation d’un tissu excitable à un stimulus augmentant lentement s’appelle l’accommodation. L'accommodation est due au fait que lors de l'augmentation de la force du stimulus, des changements actifs ont le temps de se développer dans les tissus, augmentant le seuil d'irritation et empêchant le développement de l'excitation. Ainsi, le taux d’augmentation de la stimulation au fil du temps, ou le gradient de stimulation, est essentiel à l’apparition de l’excitation.
Loi du gradient d'irritation. La réaction d'une formation vivante à un stimulus dépend du gradient de stimulation, c'est-à-dire de l'urgence ou de l'intensité de l'augmentation du stimulus au fil du temps : plus le gradient de stimulation est élevé, plus la réponse de la formation excitable.
Par conséquent, les lois de la stimulation reflètent la relation complexe entre le stimulus et la structure excitable lors de leur interaction. Pour que l’excitation se produise, le stimulus doit avoir une force seuil, une durée seuil et un certain taux d’augmentation dans le temps.
6. Pompes ioniques (ATPases) : K+-Na+-e, Ca2+-e (plasmolemme et réticulum sarcoplasmique), échangeur H+-K+.
Selon les concepts modernes, les membranes biologiques contiennent des pompes ioniques qui fonctionnent en utilisant l'énergie libre de l'hydrolyse de l'ATP - des systèmes spéciaux de protéines intégrales (ATPases de transport).
Actuellement, on connaît trois types de pompes à ions électrogéniques qui transportent activement les ions à travers la membrane (Fig. 13).
Le transfert d'ions par les ATPases de transport se produit en raison du couplage de processus de transfert avec des réactions chimiques, dues à l'énergie du métabolisme cellulaire.
Lorsque la K+-Na+-ATPase fonctionne, deux ions potassium sont transférés dans la cellule en raison de l'énergie libérée lors de l'hydrolyse de chaque molécule d'ATP et trois ions sodium sont simultanément pompés hors de la cellule. Cela crée une concentration accrue d’ions potassium dans la cellule par rapport à l’environnement intercellulaire et une diminution de la concentration de sodium, ce qui revêt une grande importance physiologique.
Signes d'une « biopompe » :
1. Mouvement contre le gradient de potentiel électrochimique.
2. le flux de matière est associé à l'hydrolyse de l'ATP (ou d'une autre source d'énergie).
3. asymétrie du véhicule de transport.
4. La pompe in vitro est capable d'hydrolyser l'ATP uniquement en présence des ions qu'elle transporte in vivo.
5. Lorsque la pompe est intégrée dans un environnement artificiel, elle est capable de maintenir sa sélectivité.
Le mécanisme moléculaire de fonctionnement des ATPases ioniques n’est pas entièrement compris. Néanmoins, les principales étapes de ce processus enzymatique complexe peuvent être retracées. Dans le cas de la K+-Na+-ATPase, il existe sept étapes de transfert d’ions associées à l’hydrolyse de l’ATP.
Le diagramme montre que les étapes clés de l’enzyme sont :
1) formation d'un complexe enzymatique avec l'ATP sur la surface interne de la membrane (cette réaction est activée par les ions magnésium) ;
2) liaison de trois ions sodium par le complexe ;
3) phosphorylation de l'enzyme avec formation d'adénosine diphosphate ;
4) révolution (bascule) de l'enzyme à l'intérieur de la membrane ;
5) la réaction d'échange d'ions du sodium en potassium, se produisant sur la surface externe de la membrane ;
6) révolution inverse du complexe enzymatique avec transfert d'ions potassium dans la cellule ;
7) retour de l'enzyme à son état d'origine avec libération d'ions potassium et de phosphate inorganique (P).
Ainsi, au cours d'un cycle complet, trois ions sodium sont libérés de la cellule, le cytoplasme s'enrichit de deux ions potassium et l'hydrolyse d'une molécule d'ATP se produit.
Dernière mise à jour : 28/10/2013
Le deuxième article de la série « Fondements de la physiologie humaine et animale ». Nous parlerons du mécanisme de formation du potentiel d'action - la base de tout mouvement.
Les cellules excitables (qui sont, à un degré ou à un autre, toutes les cellules du corps d’un animal) au repos ont un excès de charge négative et se forment. Si une cellule est soumise à une stimulation externe, elle entre dans un état excité et génère un autre potentiel : un potentiel d’action.
Ce processus est réalisé par un système de canaux ioniques dans la membrane cellulaire, qui régule les concentrations de particules chargées électriquement – les ions. Toutes les chaînes, quelle que soit leur spécialisation, sont contrôlées par certaines forces. Il peut s'agir d'une modification du potentiel sur la membrane cellulaire - dans le cas de canaux dépendants de la tension, d'une augmentation de la concentration de certaines substances actives - pour les canaux dépendants du ligand, ou d'un étirement de la membrane - pour les canaux contrôlés mécaniquement.
Les canaux sont des protéines spécifiques intégrées dans la membrane. Chaque type de canal laisse passer des ions spécifiques. Il s'agit d'un système de transport passif : les ions les traversent par diffusion, et les canaux contrôlent simplement la concentration des particules qui passent et régulent pour elles la perméabilité de la membrane.
Dans la formation du potentiel d'action, ainsi que du potentiel de repos, participent principalement les ions sodium et potassium.
Les canaux sodiques ont une structure assez simple : il s'agit d'une protéine composée de trois sous-unités différentes qui forment une structure similaire à un pore, c'est-à-dire un tube avec une lumière interne. Le canal peut être dans trois états : fermé, ouvert et inactivé (fermé et inexcitable). Ceci est assuré par la localisation des charges négatives et positives dans la protéine elle-même ; ces charges sont attirées vers celles opposées existant sur la membrane, et ainsi le canal s'ouvre et se ferme lorsque l'état de la membrane change. Lorsqu'il est ouvert, les ions sodium peuvent pénétrer librement dans la cellule selon un gradient de concentration. Il s’agit d’un instant très court – littéralement une fraction de milliseconde.
Les canaux potassiques sont encore plus simples : ce sont des sous-unités individuelles qui ont une forme trapézoïdale en section transversale ; ils sont situés presque proches les uns des autres, mais il y a toujours un écart entre eux. Les canaux potassiques ne se ferment pas complètement : au repos, le potassium quitte librement le cytoplasme (le long du gradient de concentration).
Les canaux sodium et potassium sont dépendants du potentiel : ils fonctionnent en réponse aux changements du potentiel électrique de la membrane.
Lorsqu'un potentiel d'action se forme, une forte recharge à court terme de la membrane se produit. Ceci est réalisé grâce à plusieurs processus séquentiels.
Premièrement, sous l'influence d'une irritation externe (par exemple, le courant électrique), la membrane est dépolarisée, c'est-à-dire que les charges sur ses différents côtés changent à l'opposé (à l'intérieur de la cellule, la charge devient positive, à l'extérieur - en négative). Il s'agit d'un signal d'ouverture de canaux sodiques, qui sont très nombreux à la surface d'une membrane - peut-être jusqu'à 12 000. Le moment où les canaux commencent à s’ouvrir est appelé niveau critique de dépolarisation. Le courant qui donne cette dépolarisation critique est appelé seuil.
Il est intéressant de noter que l’augmentation du courant après avoir atteint le seuil ne modifie pas les caractéristiques du potentiel d’action résultant. Ce qui compte pour l'ouverture des canaux, ce n'est pas l'amplitude du courant, mais la quantité d'énergie reçue par la membrane - la « quantité d'électricité ». Ce modèle est appelé « tout ou rien » : soit il y a une réponse complète à l'irritation lorsque sa valeur est supérieure ou égale à la valeur seuil, soit il n'y a aucune réponse si l'irritation n'a pas atteint la valeur seuil. Dans ce cas, la valeur seuil est déterminée par la durée de la stimulation appliquée.
Cette loi n’est cependant valable qu’à l’intérieur d’une seule cellule. Si nous prenons, par exemple, un nerf composé d'un grand nombre d'axones différents, l'amplitude aura également de l'importance, car nous ne verrons une réponse à la stimulation que lorsque les canaux seront activés dans toutes les cellules - c'est-à-dire avec une valeur totale plus grande. du courant de seuil.
Une fois les canaux ouverts, le sodium commence à pénétrer dans la cellule et son courant dépasse largement le courant de potassium sortant le long du gradient. Cela signifie que la perméabilité de la membrane au sodium devient supérieure à celle du potassium. À un moment donné, presque tous les canaux sodiques s'ouvrent. Cela se produit comme une avalanche : à partir du point où le stimulus est arrivé, dans les deux sens. Ainsi, la concentration de sodium dans la cellule augmente fortement.
Après cela, les concentrations d’ions devraient revenir à leurs valeurs initiales. Cela confère aux canaux une propriété générale telle que le caractère réfractaire : un canal déclenché reste inactif pendant un certain temps après et ne peut pas être excité par un stimulus irritant.
Au moment de la réponse maximale à la stimulation, les canaux sodiques deviennent réfractaires et la perméabilité au sodium chute fortement. Les canaux potassiques, au contraire, commencent à fonctionner activement et le flux de potassium provenant de la cellule augmente. Ainsi, les ions chargés positivement en excès quittent la cellule et le potentiel de repos d'origine est restauré. Durant cette période, jusqu'à ce que les canaux sodiques et le potentiel d'origine soient restaurés (cela peut prendre environ une milliseconde), la cellule n'est pas capable de s'exciter.
Étant donné que la capacité des cellules à exciter assure le fonctionnement du corps dans son ensemble et la possibilité d'un contrôle centralisé de toutes les cellules du corps, les poisons qui bloquent les canaux sont parmi les plus dangereux pour l'homme et de nombreux animaux.
L’un des bloqueurs de canaux les plus dangereux est la tétrodotoxine, une substance produite par le poisson-globe. Pour cela, la valeur DL50 (niveau de mortalité de 50 % - la dose à partir de laquelle 50 personnes sur cent mourront) est égale à 10 milligrammes par kilogramme de poids, soit environ mille fois moins que pour le cyanure. Ses molécules se lient étroitement à la protéine du canal sodium lorsqu'elle est dans un état fermé et bloquent complètement la possibilité d'un potentiel d'action. Certaines algues produisent des toxines similaires. Le venin du Scorpion, au contraire, maintient tous les canaux dans un état constamment ouvert.
Bon, d'accord, un scorpion, mais pourquoi une arme aussi terrible contre les algues est un mystère.
Avez-vous quelque chose à dire? Laissez un commentaire!.
Canaux ioniques représenté par des protéines membranaires intégrales. Ces protéines sont capables, sous certaines influences, de modifier leur conformation (forme et propriétés) de telle sorte que le pore par lequel peut passer n'importe quel ion s'ouvre ou se ferme. Les canaux sodium, potassium, calcium et chlore sont connus ; parfois un canal peut laisser passer deux ions, par exemple, les canaux sodium-calcium sont connus. Seul le transport passif des ions se produit à travers les canaux ioniques. Cela signifie que pour qu’un ion se déplace, il faut non seulement un canal ouvert, mais également un gradient de concentration pour cet ion. Dans ce cas, l'ion se déplacera le long d'un gradient de concentration - d'une zone avec une concentration plus élevée vers une zone avec une concentration plus faible. Il ne faut pas oublier que nous parlons d'ions - des particules chargées dont le transport est également déterminé par la charge. Des situations sont possibles lorsque le mouvement le long du gradient de concentration peut être dirigé dans une direction et que les charges existantes contrecarrent ce transfert.
Les canaux ioniques ont deux propriétés importantes : 1) sélectivité (sélectivité) envers certains ions et 2) possibilité d'ouvrir (activer) et de fermer. Lorsqu'il est activé, le canal s'ouvre et laisse passer les ions (Fig. 8). Ainsi, le complexe de protéines intégrales qui forment le canal doit nécessairement comprendre deux éléments : des structures qui reconnaissent « leur » ion et sont capables de le laisser passer, et des structures qui permettent de savoir quand laisser passer cet ion. La sélectivité du canal est déterminée par les protéines qui le composent ; le « propre » ion est reconnu par sa taille et sa charge.
Activation de la chaîne possible de plusieurs manières. Premièrement, les canaux peuvent s’ouvrir et se fermer à mesure que le potentiel membranaire change. Le changement de charge entraîne une modification de la conformation des molécules protéiques et le canal devient perméable à l'ion. Pour modifier les propriétés du canal, une légère fluctuation du potentiel de membrane suffit. De tels canaux sont appelés dépendant de la tension(ou à commande électrique). Deuxièmement, les canaux peuvent faire partie d’un complexe protéique complexe appelé récepteur membranaire. Dans ce cas, la modification des propriétés du canal est provoquée par un réarrangement conformationnel des protéines, qui résulte de l'interaction du récepteur avec une substance biologiquement active (hormone, médiateur). De tels canaux sont appelés chimiodépendant(ou dépendant du récepteur ) . De plus, les canaux peuvent s'ouvrir sous influence mécanique - pression, étirement (Fig. 9). Le mécanisme qui assure l'activation est appelé canalisation. En fonction de la vitesse à laquelle les canaux s'ouvrent et se ferment, ils peuvent être divisés en rapides et lents.
La plupart des canaux (potassium, calcium, chlorure) peuvent être dans deux états : ouvert et fermé. Il existe certaines particularités dans le fonctionnement des canaux sodiques. Ces canaux, comme le potassium, le calcium et le chlorure, ont tendance à être soit dans un état ouvert soit fermé, cependant, le canal sodium peut également être inactivé, c'est un état dans lequel le canal est fermé et ne peut être ouvert par aucune influence ( Fig.10).
Figure 8. États des canaux ioniques
Figure 9. Exemple de canal dépendant du récepteur. ACh – acétylcholine. L'interaction de la molécule ACh avec le récepteur membranaire modifie la conformation de la protéine porte de telle sorte que le canal commence à laisser passer les ions.
Figure 10 Exemple de canal dépendant du potentiel
Le canal sodium voltage-dépendant possède des portes d'activation et d'inactivation (portes). Les portes d'activation et d'inactivation changent de conformation à différents potentiels de membrane.
Lors de l'examen des mécanismes d'excitation, nous nous intéresserons principalement au travail des canaux sodiques et potassiques, cependant, attardons-nous brièvement sur les caractéristiques des canaux calciques, nous en aurons besoin à l'avenir. Les canaux sodiques et calciques diffèrent par leurs propriétés. Les canaux sodiques sont rapides et lents, tandis que les canaux calciques ne sont que lents. L'activation des canaux sodiques entraîne uniquement une dépolarisation et l'apparition de LO ou d'AP ; l'activation des canaux calciques peut en outre provoquer des changements métaboliques dans la cellule. Ces changements sont dus au fait que le calcium se lie à des protéines spéciales sensibles à cet ion. La protéine liée au calcium modifie ses propriétés de telle manière qu'elle devient capable de modifier les propriétés d'autres protéines, par exemple en activant des enzymes, en déclenchant une contraction musculaire et en libérant des médiateurs.
Les canaux ioniques sont formés de protéines ; ils sont très divers dans leur structure et leur mécanisme d'action. Plus de 50 types de canaux sont connus, chaque cellule nerveuse possède plus de 5 types de canaux. L'état d'activation d'un canal ionique déclenché dure généralement environ 1 ms, parfois jusqu'à 3 ms et bien plus longtemps, et 12 à 20 millions d'ions peuvent passer par un canal.
Les canaux ioniques sont classés selon plusieurs critères.
Selon la possibilité de contrôler leur fonction, on distingue les canaux contrôlés et non contrôlés (canaux de fuite d'ions). À travers des canaux non contrôlés, les ions se déplacent constamment, mais lentement, naturellement, en présence d'un gradient électrochimique, comme dans le cas d'un mouvement rapide d'ions à travers des canaux contrôlés. Les canaux contrôlés ont des portes avec des mécanismes de contrôle, de sorte que les ions ne peuvent les traverser que lorsque la porte est ouverte.
En fonction de la vitesse de déplacement des ions, les canaux peuvent être rapides ou lents. Par exemple, un potentiel d’action dans les muscles squelettiques résulte de l’activation des canaux Na et K rapides. Dans le développement du potentiel d'action du muscle cardiaque, outre les canaux rapides pour Na+ et K+, les canaux lents - calcium, potassium et sodium - jouent un rôle important.
Selon le stimulus, activant ou inactivant, les canaux ioniques contrôlés sont divisés en plusieurs types :
- a) potentiellement sensible,
- b) chimiosensible,
- c) mécanosensible,
- d) sensible au calcium,
- e) canaux sensibles aux seconds messagers.
Ces derniers sont localisés dans les membranes intracellulaires, ils n'ont pas été suffisamment étudiés, ainsi que les canaux sensibles au calcium. Lorsqu'un médiateur (ligand) interagit avec des récepteurs situés à la surface de la membrane cellulaire, les portes des canaux chimiosensibles peuvent s'ouvrir, c'est pourquoi on les appelle également canaux déclenchés par les récepteurs. L i g a n d est une substance biologiquement active ou un médicament pharmacologique qui active ou bloque un récepteur. L'ouverture des canaux chimiosensibles résulte de changements conformationnels dans le complexe récepteur. Les portes des canaux dépendants du potentiel s'ouvrent et se ferment lorsque le potentiel de membrane change. Par conséquent, la conception de leur mécanisme de porte doit contenir des particules porteuses d’une charge électrique. Les canaux mécanosensibles sont activés et inactivés par compression et étirement. Les canaux sensibles au calcium sont activés, comme son nom l'indique, par le calcium, et le Ca2+ peut activer à la fois ses propres canaux, par exemple les canaux Ca du réticulum sarcoplasmique, et les canaux d'autres ions, par exemple les canaux ioniques K+. Les membranes des cellules excitables (muscles lisses et striés, y compris le muscle cardiaque, le système nerveux) contiennent des canaux sensibles au voltage, à la chimio, à la mécano et au calcium. Il convient de noter que les canaux détectant le calcium sont un exemple de canaux chimiosensibles.
En fonction de la sélectivité, on distingue les canaux sélectifs aux ions, qui ne laissent passer qu'un seul ion, et les canaux qui n'ont pas de sélectivité. Il existe des canaux sélectifs Na-, K-, Ca-, C1- et Na/Ca. Il existe des canaux qui laissent passer plusieurs ions, par exemple Na+, K+ et Ca2+ dans les cellules du myocarde, c'est-à-dire manque de sélectivité. Le degré de sélectivité est le plus élevé pour les canaux sensibles au potentiel (dépendants de la tension) ; il est légèrement inférieur pour les canaux chimiosensibles (dépendants du récepteur). Par exemple, lorsque l'acétylcholine agit sur le récepteur H-cholinergique de la membrane postsynaptique de la synapse neuromusculaire, des canaux ioniques sont activés par lesquels passent simultanément les ions Na+, K+ et Ca2+. Les canaux mécanosensibles sont généralement non sélectifs pour les ions monovalents et le Ca2+.
Un même ion peut avoir plusieurs types de canaux. Les plus importants d'entre eux pour la formation de biopotentiels sont les suivants.
Chaînes pour K+ :
- a) des canaux de repos incontrôlés (canaux de fuite) à travers lesquels K+ quitte constamment la cellule, qui est le principal facteur de formation du potentiel membranaire (potentiel de repos) ;
- b) canaux K commandés sensibles à la tension ;
- c) Canaux K activés par Ca2+ ;
- d) des canaux activés par d'autres ions et substances, par exemple l'acétylcholine, qui assure l'hyperpolarisation des myocytes cardiaques.
Canaux pour Na+ - contrôlés rapides et lents et non contrôlés (canaux de fuite d'ions) :
- a) canaux Na rapides sensibles à la tension - rapidement activés lorsque le potentiel membranaire diminue, assurent l'entrée de Na+ dans la cellule lors de son excitation ;
- b) canaux Na dépendants des récepteurs activés par l'acétylcholine dans la synapse neuromusculaire, le glutamate dans les synapses des neurones du SNC ;
- c) Canaux Na lents et incontrôlés : canaux de fuite à travers lesquels Na+ se diffuse constamment dans la cellule et entraîne avec lui d'autres molécules, telles que le glucose, les acides aminés et les molécules porteuses. Ainsi, les canaux de fuite de Na assurent le transport secondaire des substances et la participation de Na+ à la formation du potentiel membranaire.
Les canaux Ca2+ sont très divers et très complexes : dépendants du récepteur et dépendants du potentiel, lents et rapides :
- a) les canaux calciques lents sensibles au potentiel (nouveau nom : type L), activés lentement lors de la dépolarisation de la membrane cellulaire, provoquent une entrée lente du Ca2+ dans la cellule et un potentiel calcique lent, par exemple dans les cardiomyocytes. Disponible dans les muscles striés et lisses, dans les neurones du système nerveux central ;
- b) les canaux rapides sensibles à la tension calcique du réticulum sarcoplasmique assurent la libération de Ca2+ dans le hyaloplasme et le couplage électromécanique.
Canaux de chlore sont présents dans les myocytes squelettiques et cardiaques, les érythrocytes, en petites quantités dans les neurones et concentrés dans les synapses. Les canaux C1 voltage-dépendants sont présents dans les cardiomyocytes, dépendants des récepteurs dans les synapses du système nerveux central et sont activés par les transmetteurs inhibiteurs GABA et glycine.
Structure des canaux ioniques et leur fonctionnement. Les canaux ont une sortie et un filtre sélectif, et les canaux contrôlés ont un mécanisme de porte ; les canaux sont remplis de liquide et leurs dimensions sont de 0,3 à 0,8 nm. La sélectivité des canaux ioniques est déterminée par leur taille et la présence de particules chargées dans le canal. Ces particules ont une charge opposée à la charge de l'ion qu'elles attirent, ce qui assure le passage de l'ion à travers ce canal (comme on sait que les charges se repoussent). Les particules non chargées peuvent également traverser les canaux ioniques. Les ions traversant le canal doivent se débarrasser de la coque d'hydratation, sinon leurs dimensions seront supérieures aux dimensions du canal. Le diamètre de l'ion Na+, par exemple, avec une coque d'hydratation est de 0,3 nm, et sans coque d'hydratation, il est de 0,19 nm. Un ion trop petit, passant à travers un filtre sélectif, ne peut pas abandonner la coque d'hydratation et ne peut donc pas traverser le canal. Cependant, il semble exister d’autres mécanismes de sélectivité des membranes cellulaires. L'hypothèse du tamisage ne peut pas expliquer, par exemple, pourquoi K+ ne passe pas à travers les canaux ouverts de Na au début du cycle d'excitation cellulaire, mais elle fournit néanmoins une explication satisfaisante, et dans certains cas absolument convaincante, de la perméabilité sélective des membranes cellulaires pour différentes particules et ions.
Les canaux du même type peuvent s’influencer mutuellement. Ainsi, l'ouverture de certains canaux contrôlés électriquement favorise l'activation de canaux électrosensibles proches, tandis que l'ouverture d'un canal chimio- ou mécanosensible et le passage d'ions à travers celui-ci n'affectent pratiquement pas l'état des canaux similaires voisins. La dépolarisation partielle de la membrane cellulaire due à l'activation des canaux mécanosensibles peut conduire à l'activation des canaux Na+, K+ (ou Cl-) et Ca2+ sensibles au potentiel.
Les canaux ioniques sont bloqués par des substances spécifiques et des médicaments pharmacologiques, largement utilisés à des fins thérapeutiques. Un bloqueur spécifique des canaux mécanosensibles est le Gadolinium (Gd3+). Les bloqueurs de divers canaux sensibles à la tension sont différents médicaments ou produits chimiques. Par exemple, l'atropine est un bloqueur du canal chimiosensible (sensible aux récepteurs) des cellules effectrices activé par l'acétylcholine. Les canaux Na dépendants du potentiel sont bloqués par la tétrodotoxine (agit uniquement à l'extérieur de la cellule) ; calcium - ions divalents, par exemple nickel, ions manganèse, ainsi que vérapamil, nifédipine. Le nombre de canaux ioniques sur la membrane cellulaire est énorme. Ainsi, il existe environ 50 canaux Na pour 1 µm2 ; en moyenne, ils sont situés à une distance de 140 nm les uns des autres. Une étude réussie des canaux ioniques permet de mieux comprendre le mécanisme d'action des médicaments pharmacologiques et donc de les utiliser avec plus de succès en pratique clinique. La novocaïne, par exemple, en tant qu'anesthésique local, soulage la douleur car, en bloquant les canaux Na, elle arrête la conduction de l'excitation le long des fibres nerveuses.
Consommation d'énergie lors du transport de substances à travers la membrane. Une partie importante de l'énergie est dépensée pour les processus de transport de substances dans le corps. Néanmoins, le transport de substances s'effectue de manière très économique, puisque généralement le transport de certaines particules assure le passage d'autres, comme en témoignent de nombreux faits.
Lors du fonctionnement de la pompe Na/K, de l'énergie est dépensée pour le transfert de Na+ de la cellule vers son environnement, tandis que le transfert de K+ dans la cellule s'effectue sans dépense énergétique directe du fait de la conformation de la molécule protéique ( Na/K-ATPase) après ajout de K+ à sa zone active.
La création d'un gradient de concentration d'ions, provoquant l'apparition d'un potentiel membranaire, forme simultanément un gradient osmotique, qui à son tour crée les conditions préalables au mouvement directionnel de l'eau. Le gradient électrique créé participe au transfert des particules chargées, assure l'apparition d'un potentiel d'action et la propagation de l'excitation.
Le processus de déplacement de l'eau d'une zone à une autre, selon la loi de l'osmose, assure le transport de toutes les particules qui y sont dissoutes et capables de passer à travers des filtres biologiques (en suivant le solvant). L'énergie n'est pas directement dépensée pour la transition de l'eau (transport secondaire) et, bien entendu, l'énergie n'est pas dépensée pour le transfert des particules dissoutes dans l'eau, qui suivent l'eau.
Le transport dépendant du sodium (transport de non-électrolytes) nécessite de l'énergie pour transporter le Na+ depuis la cellule, mais souvent la diffusion du Na+ dans la cellule assure le mouvement des porteurs membranaires connectés aux molécules de glucose et aux acides aminés. Par conséquent, le glucose et les acides aminés peuvent pénétrer dans la cellule avec Na+ (symport). La recapture de l'émetteur dans la terminaison présynaptique à partir de la fente synaptique des synapses du système nerveux central s'effectue également à l'aide d'un mécanisme similaire. Le transport dépendant du sodium peut également assurer des mouvements de navette de molécules porteuses, qui à leur tour transportent les ions Ca2+, H+ depuis la cellule (contre-transport, antiport) en fonction du gradient de concentration des porteurs.
Le glucose et les acides aminés sont transportés secondairement activement par diffusion facilitée sans dépense énergétique directe.
La diffusion des gaz dans les poumons entre l'air et le sang, ainsi que dans les tissus entre le sang et l'interstitium, se produit sans aucune dépense énergétique, tout comme l'échange d'HCO3 et d'ions Cl- entre les globules rouges et le plasma lorsque le sang se trouve dans divers tissus du corps et des poumons. La diffusion de substances de l'intestin, par exemple le glucose dans le sang après ingestion d'aliments, si sa concentration dans l'intestin est plus élevée, se produit selon un gradient de concentration, pour la création duquel les cellules du corps ne dépensent pas d'énergie. Ces deux cas (diffusion de gaz dans les poumons, de tissus et de particules dans les intestins) constituent une exception lorsque le transport dans l'organisme s'effectue sans aucune dépense énergétique. Cependant, l'énergie est dépensée pour acheminer ces substances vers le corps - mouvements respiratoires, cuisson des aliments et transformation dans le système digestif.
L'énergie dépensée par le cœur pour le mouvement du sang dans les vaisseaux assure non seulement le transport de toutes les substances, y compris les gaz, par le sang, mais aussi la formation d'un filtrat (le mouvement de toutes les particules) dans les tissus du corps. et la formation d'urine.
Ainsi, le transport primaire de plusieurs ions, dont le principal est Na+, assure le transport de la grande majorité des substances dans l’organisme.
Tous les types de transports jouent un rôle vital dans la vie des cellules et de l’organisme dans son ensemble. En particulier, le transport d'ions assure la formation de potentiels membranaires dans les cellules des tissus musculaires et nerveux ; l'une des fonctions de ces dernières est la régulation de divers systèmes de l'organisme.
Pour diverses substances et notamment pour les ions minéraux, il est extrêmement important dans la vie de la cellule et notamment dans les mécanismes de perception, de transformation, de transmission des signaux de cellule à cellule et aux structures intracellulaires.
Le rôle déterminant dans l'état de perméabilité des membranes cellulaires est joué par leurs canaux ioniques, qui se forment protéines formant des canaux. L'ouverture et la fermeture de ces canaux peuvent être contrôlées par l'ampleur de la différence de potentiel entre les surfaces externe et interne de la membrane, diverses molécules de signalisation (hormones, neurotransmetteurs, substances vasoactives), messagers secondaires de la transmission du signal intracellulaire et minéraux. ions.
Canal ionique- plusieurs sous-unités (protéines membranaires intégrales contenant des segments transmembranaires ayant chacune une configuration en hélice α) qui assurent le transport des ions à travers la membrane.
Riz. 1. Classification des canaux ioniques
La compréhension moderne de la structure et de la fonction des canaux ioniques est devenue possible grâce au développement de méthodes d'enregistrement des courants électriques circulant à travers une section isolée de la membrane contenant des canaux ioniques uniques, ainsi qu'à l'isolement et au clonage de gènes individuels qui contrôlent la synthèse de macromolécules protéiques capables de former des canaux ioniques. Cela a permis de modifier artificiellement la structure de ces molécules, de les intégrer dans les membranes cellulaires et d'étudier le rôle de régions peptidiques individuelles dans l'exécution des fonctions des canaux. Il s'est avéré que les molécules protéiques formant des canaux de tous les canaux ioniques ont des caractéristiques structurelles communes et sont généralement sont représentés par de grosses protéines transmembranaires avec des masses moléculaires supérieures à 250 kDa.
Ils sont constitués de plusieurs sous-unités. Généralement le plus important propriétés du canal leur une sous-unité. Cette sous-unité participe à la formation du trou sélectif des ions, le mécanisme capteur de la différence de potentiel transmembranaire - la porte du canal, et possède des sites de liaison pour les ligands exogènes et endogènes. D'autres sous-unités incluses dans la structure des canaux ioniques jouent un rôle auxiliaire, modulant les propriétés des canaux (Fig. 2).
La molécule protéique formant des canaux est représentée par des boucles d'acides aminés extramembranaires et des régions de domaines hélicoïdaux intramembranaires qui forment les sous-unités des canaux ioniques. La molécule protéique se replie dans le plan de la membrane de sorte que le canal ionique lui-même se forme entre les domaines en contact les uns avec les autres (voir Fig. 2, en bas à droite).
La molécule protéique formant un canal est située dans la membrane cytoplasmique de sorte que sa structure spatiale tridimensionnelle forme les embouchures du canal faisant face aux côtés extérieur et intérieur de la membrane, un pore rempli d'eau et une « porte ». Ces derniers sont formés par une section de la chaîne peptidique qui peut facilement changer de conformation et déterminer l'état ouvert ou fermé du canal. La sélectivité et la perméabilité du canal ionique dépendent de la taille du pore et de sa charge. La perméabilité d'un canal pour un ion donné est également déterminée par sa taille, sa charge et sa coque d'hydratation.

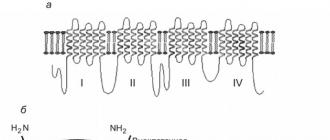
Riz. 2. Structure du canal ionique Na+ de la membrane cellulaire : a - structure bidimensionnelle de l'unité α du canal ionique de la membrane cellulaire ; b - à gauche - un canal sodique, constitué d'une sous-unité a et de deux sous-unités P (vue latérale) ; à droite, le canal sodium vu d'en haut. En numéros I. II. III. Domaines marqués IV de la sous-unité a
Types de canaux ioniques
Plus de 100 types de canaux ioniques ont été décrits et diverses approches sont utilisées pour les classer. L'un d'eux repose sur la prise en compte des différences dans la structure des canaux et des mécanismes de fonctionnement. Dans ce cas, les canaux ioniques peuvent être divisés en plusieurs types :
- canaux ioniques passifs, ou canaux de repos ;
- canaux de contact à fente ;
- canaux dont l'état (ouvert ou fermé) est contrôlé par l'influence sur leur mécanisme de porte de facteurs mécaniques (canaux mécanosensibles), de différences de potentiel sur la membrane (canaux dépendants de la tension) ou de ligands qui se lient à la protéine formant le canal sur la face externe ou interne de la membrane (canaux dépendants du ligand).
Canaux passifs
Une particularité de ces canaux est qu'ils peuvent être ouverts (actifs) dans les cellules au repos, c'est-à-dire en l'absence de toute influence. Cela prédétermine leur deuxième nom - canaux passifs. Ils ne sont pas strictement sélectifs et, à travers eux, la membrane cellulaire peut « laisser échapper » plusieurs ions, par exemple K+ et CI+, K+ et Na+. C’est pourquoi ces canaux sont parfois appelés canaux de fuite. En raison des propriétés énumérées, les canaux au repos jouent un rôle important dans l'émergence et le maintien du potentiel membranaire au repos sur la membrane cytoplasmique de la cellule, dont les mécanismes et la signification sont discutés ci-dessous. Des canaux passifs sont présents dans les membranes cytoplasmiques des fibres nerveuses et de leurs terminaisons, les cellules striées, les muscles lisses, le myocarde et d'autres tissus.
Canaux mécanosensibles
L'état de perméabilité de ces canaux change sous l'influence mécanique de la membrane, provoquant une perturbation de l'emballage structurel des molécules dans la membrane et son étirement. Ces canaux sont largement représentés dans les mécanorécepteurs des vaisseaux sanguins, des organes internes, de la peau, des muscles striés et des myocytes lisses.
Canaux dépendants de la tension
L'état de ces canaux est contrôlé par les forces du champ électrique créé par l'ampleur de la différence de potentiel à travers la membrane. Les canaux dépendants de la tension peuvent être dans des états inactifs (fermés), actifs (ouverts) et inactivés, qui sont contrôlés par la position des portes d'activation et d'inactivation, en fonction de la différence de potentiel à travers la membrane.
Dans une cellule au repos, un canal dépendant de la tension est généralement dans un état fermé, à partir duquel il peut être ouvert ou activé. La probabilité de son ouverture indépendante est faible et, au repos, seul un petit nombre de ces canaux dans la membrane sont ouverts. Une diminution de la différence de potentiel transmembranaire (dépolarisation membranaire) provoque l'activation du canal, augmentant ainsi la probabilité de son ouverture. On suppose que la fonction de porte d'activation est assurée par un groupe d'acides aminés chargé électriquement qui ferme l'entrée de l'embouchure du canal. Ces acides aminés sont un capteur de la différence de potentiel sur la membrane ; lorsqu'un certain niveau (critique) de dépolarisation membranaire est atteint, la partie chargée de la molécule capteur se déplace vers le microenvironnement lipidique de la molécule formant le canal et la porte ouvre l'entrée de l'embouchure du canal (Fig. 3).
Le canal devient ouvert (actif) pour que les ions puissent le traverser. La vitesse d'ouverture du portail d'activation peut être faible ou très élevée. Selon cet indicateur, les canaux ioniques voltage-dépendants sont divisés en rapides (par exemple, canaux sodium voltage-dépendants rapides) et lents (par exemple, canaux calciques voltage-dépendants lents). Les canaux rapides s'ouvrent instantanément (μs) et restent ouverts pendant 1 ms en moyenne. Leur activation s'accompagne d'une augmentation rapide, semblable à une avalanche, de la perméabilité du canal pour certains ions.
Une autre partie de la chaîne peptidique, qui est une séquence d'acides aminés sous la forme d'une boule dense (boule) sur un fil, située à la sortie de l'autre embouchure du canal, a la capacité de changer de conformation. Lorsque le signe de la charge sur la membrane change, la bille ferme la sortie de la bouche et le canal devient impénétrable (inactivé) pour l'ion. L'inactivation des canaux ioniques voltage-dépendants peut être réalisée par d'autres mécanismes. L'inactivation s'accompagne de l'arrêt du mouvement des ions à travers le canal et peut se produire aussi rapidement que l'activation, ou lentement - sur une période de quelques secondes, voire quelques minutes.

Riz. 3. Mécanisme de porte des canaux sodium (en haut) et potassium (en bas) dépendants du potentiel
Pour restaurer les propriétés originales des canaux ioniques après leur inactivation, il est nécessaire de restituer la conformation spatiale originale de la protéine formant le canal et la position de la porte. Ceci est réalisé en rétablissant la différence de potentiel membranaire (repolarisation) à un niveau caractéristique de l'état de repos de la cellule ou quelque temps après l'inactivation avec un fort effet sur la membrane. La transition de l'état d'inactivation à l'état d'origine (fermé) est appelée réactivation du canal. Une fois réactivé, le canal ionique revient à un état prêt à sa réouverture. La réactivation des canaux membranaires tension-dépendants peut également être rapide ou lente.
Les canaux ioniques voltage-dépendants sont généralement très sélectifs et jouent un rôle crucial dans l'apparition de l'excitation (génération de potentiels d'action), la transmission d'informations le long des fibres nerveuses sous forme de signaux électriques, ainsi que l'initiation et la régulation de la contraction musculaire. Ces canaux sont largement représentés dans les membranes des fibres nerveuses afférentes et efférentes, dans les membranes des myocytes striés et lisses.
Les canaux ioniques dépendant du potentiel sont intégrés dans la membrane des terminaisons nerveuses des nerfs sensoriels (dendrites) innervant la pulpe dentaire et la muqueuse buccale, où leur ouverture assure la conversion du potentiel récepteur en influx nerveux et sa transmission ultérieure le long du nerf afférent. fibre. À l'aide de ces impulsions, des informations sur tous les types de sensations sensorielles qu'une personne éprouve dans la cavité buccale (goût, température, pression mécanique, douleur) sont transmises au système nerveux central. De tels canaux assurent l'émergence de l'influx nerveux sur la membrane de la butte axonale des neurones et leur transmission le long des fibres nerveuses efférentes, la conversion des potentiels postsynaptiques en potentiels d'action des cellules effectrices postsynaptiques. Un exemple de tels processus est la génération d'influx nerveux dans les motoneurones du noyau du nerf trijumeau, qui sont ensuite transmis le long de ses fibres efférentes aux muscles masticateurs et assurent l'initiation et la régulation des mouvements de mastication de la mâchoire inférieure.
Lors de l'étude des mécanismes subtils du fonctionnement des canaux ioniques voltage-dépendants, il a été révélé qu'il existe des substances capables de bloquer le fonctionnement de ces canaux. L’une des premières à être décrite a été la substance tétrodotoxine, un puissant poison produit dans le corps du poisson-globe. Sous son influence, un blocage des canaux sodiques voltage-dépendants a été observé dans l'expérience, et lorsqu'il a été introduit dans le corps des animaux, une perte de sensibilité, un relâchement musculaire, une immobilité, un arrêt respiratoire et la mort ont été notés. Ces substances sont appelées bloqueurs de canaux ioniques. Parmi eux lidocaïne, novocaïne, procaïne - substances, lorsqu'elles sont introduites dans le corps à petites doses, un blocage des canaux sodiques dépendants de la tension des fibres nerveuses se développe et la transmission des signaux des récepteurs de la douleur au système nerveux central est bloquée. Ces substances sont largement utilisées dans la pratique médicale comme anesthésiques locaux.
Le mouvement des ions à travers les canaux ioniques est non seulement à la base de la redistribution des charges sur les membranes et de la formation de potentiels électriques, mais peut également influencer le déroulement de nombreux processus intracellulaires. Cet effet sur l'expression des gènes qui contrôlent la synthèse des protéines formant des canaux ne se limite pas aux cellules des tissus excitables, mais se produit dans toutes les cellules du corps. Un grand groupe de maladies a été identifié, dont la cause est une violation de la structure et de la fonction des canaux ioniques. Ces maladies sont classées comme « canalopathies ». Évidemment, la connaissance de la structure et des fonctions des canaux ioniques est nécessaire pour comprendre la nature des « canalopathies » et rechercher leur thérapie spécifique.
Canaux ioniques dépendants d'un ligand
Ils sont généralement formés de macromolécules protéiques qui peuvent simultanément servir de canaux ioniques et de fonctions de récepteur pour certains ligands. Étant donné qu'une même macromolécule peut remplir simultanément ces deux fonctions, des noms différents leur ont été attribués - par exemple, récepteur synaptique ou canal ligand-dépendant.
Contrairement à un canal ionique dépendant de la tension, qui s'ouvre lorsque la conformation de la porte d'activation change dans des conditions de diminution de la différence de potentiel transmembranaire, les canaux ioniques dépendants du ligand s'ouvrent (s'activent) lors de l'interaction de la chaîne peptidique (réceptrice) d'une protéine. molécule avec un ligand, substance pour laquelle le récepteur a une forte affinité ( Fig. 4).

Riz. 4. Canal ionique dépendant du ligand (récepteur de l'acétylcholine sensible à la nicotine - n-ChR) : un inactif ; 6 - activé
Les canaux ioniques ligand-dépendants sont généralement localisés dans les membranes postsynaptiques des cellules nerveuses et de leurs processus, ainsi que dans les fibres musculaires. Des exemples typiques de canaux ioniques dépendants d'un ligand sont les canaux membranaires postsynaptiques activés par l'acétylcholine (voir Fig. 4), le glutamate, l'aspartate, l'acide gamma-aminobutyrique, la glycine et d'autres neurotransmetteurs synaptiques. En règle générale, le nom du canal (récepteur) reflète le type de neurotransmetteur qui est son ligand dans des conditions naturelles. Ainsi, s'il s'agit de canaux de la synapse neuromusculaire dans lesquels le neurotransmetteur acétylcholine est utilisé, alors le terme « récepteur de l'acétylcholine » est utilisé, et s'il est également sensible à la nicotine, alors il est appelé sensible à la nicotine, ou simplement n-acétylcholine. récepteur (récepteur n-cholinergique).
En règle générale, les récepteurs post-synaptiques (canaux) se lient sélectivement à un seul type de neurotransmetteur. En fonction du type et des propriétés du récepteur et du neurotransmetteur en interaction, les canaux modifient sélectivement leur perméabilité aux ions minéraux, mais ce ne sont pas des canaux strictement sélectifs. Par exemple, les canaux dépendants du ligand peuvent modifier la perméabilité aux cations Na+ et K+ ou aux anions K+ et CI+. Cette sélectivité de liaison du ligand et les modifications de la perméabilité ionique sont génétiquement fixées dans la structure spatiale de la macromolécule.
Si l'interaction du médiateur et de la partie réceptrice de la macromolécule qui forme le canal ionique s'accompagne directement d'une modification de la perméabilité du canal, cela conduit en quelques millisecondes à une modification de la perméabilité de la membrane post-synaptique aux minéraux. ions et la valeur du potentiel postsynaptique. De tels canaux sont appelés rapides et sont localisés, par exemple, dans la membrane postsynaptique des synapses excitatrices axo-dendritiques et des synapses inhibitrices axosomatiques.
Il existe des canaux ioniques lents dépendants du ligand. Contrairement aux canaux rapides, leur ouverture n'est pas médiée par l'interaction directe du neurotransmetteur avec la macromolécule du récepteur, mais par une chaîne d'événements comprenant l'activation de la protéine G, son interaction avec le GTP, une augmentation du niveau de messagers secondaires dans la transmission intracellulaire. du signal du neurotransmetteur qui, en phosphorylant le canal ionique, entraîne une modification de sa perméabilité aux ions minéraux et une modification correspondante de la valeur du potentiel postsynaptique. L'ensemble de la chaîne d'événements décrite se déroule en quelques centaines de millisecondes. Nous rencontrerons de tels canaux ioniques lents et dépendants du ligand lors de l'étude des mécanismes de régulation du cœur et des muscles lisses.
Un type particulier sont les canaux localisés dans les membranes du réticulum endoplasmique des cellules musculaires lisses. Leur ligand est le deuxième messager de la transduction du signal intracellulaire, l'inositol tri-phosphate-IFZ.
L'invention concerne des canaux ioniques caractérisés par certaines propriétés structurelles et fonctionnelles inhérentes aux canaux ioniques à la fois dépendants du potentiel et dépendants du ligand. Ce sont des canaux ioniques insensibles à la tension, dont l'état du mécanisme de porte est contrôlé par des nucléotides cycliques (AMPc et GMPc). Dans ce cas, les nucléotides cycliques se lient à la terminaison COOH intracellulaire de la molécule protéique formant un canal et activent le canal.
Ces canaux se caractérisent par une moindre sélectivité de perméabilité pour les cations et la capacité de ces derniers à influencer la perméabilité de chacun. Ainsi, les ions Ca 2+, entrant par les canaux activés depuis l'environnement extracellulaire, bloquent la perméabilité des canaux aux ions Na 2+. Un exemple de tels canaux sont les canaux ioniques en bâtonnets de la rétine, dont la perméabilité aux ions Ca 2+ et Na 2+ est déterminée par le niveau de GMPc.
Les canaux ioniques ligand-dépendants sont largement représentés dans les structures membranaires qui assurent la transmission synaptique des signaux provenant d'un certain nombre de récepteurs sensoriels du système nerveux central ; transmission de signaux au niveau des synapses du système nerveux ; transmission des signaux du système nerveux aux cellules effectrices.
Il a déjà été noté que la transmission directe des commandes du système nerveux à de nombreux organes effecteurs s'effectue à l'aide de neurotransmetteurs qui activent les canaux ioniques ligand-dépendants dans les membranes postsynaptiques. Cependant, leurs ligands (agonistes ou antagonistes) peuvent également être des substances de nature exogène, qui dans certains cas sont utilisées comme substances médicinales.
Par exemple, après l'introduction dans le corps de la substance diplacine, dont la structure est similaire à celle du neurotransmetteur apétylcholine, il y aura une ouverture prolongée des canaux ioniques dépendants du ligand au niveau des synapses neuromusculaires, qui cesseront de transmettre l'influx nerveux des fibres nerveuses aux muscles. . Il se produit une relaxation des muscles squelettiques du corps, qui peut être nécessaire lors d'opérations chirurgicales complexes. La diplacine et d'autres substances qui peuvent modifier l'état des canaux ioniques dépendants du ligand et bloquer la transmission du signal au niveau des synapses neuromusculaires sont appelées relaxants musculaires.

Riz. 5. Canaux de jonction entre deux cellules étroitement en contact
Dans la pratique médicale, de nombreuses autres substances médicinales sont utilisées pour affecter l'état des canaux ioniques dépendants du ligand des cellules de divers tissus.
Canaux de jonction (étroits) entre les cellules
Des canaux de jonction lacunaire se forment dans la zone de contact entre deux cellules voisines très proches l'une de l'autre. Dans la membrane de chaque cellule en contact, six sous-unités protéiques, appelées connexines, forment une structure hexagonale, au centre de laquelle se forme un pore ou un canal ionique - un connexon (Fig. 5).
Une structure miroir se forme au point de contact dans la membrane d'une cellule adjacente et le canal ionique entre elles devient commun. Grâce à ces canaux ioniques, divers ions minéraux, notamment les ions Ca 2+, ainsi que des substances organiques de faible poids moléculaire, peuvent se déplacer d'une cellule à l'autre. Les canaux des jonctions lacunaires des cellules assurent le transfert d'informations entre les cellules du myocarde, des muscles lisses, de la rétine et du système nerveux.
Canaux sodiques
Les canaux sodiques dépendants de la tension et indépendants de la tension (dépendants du ligand, mécanosensibles, passifs, etc.) sont largement représentés dans les cellules de l'organisme.
Canaux sodium dépendants du potentiel
Ils sont constitués d'une sous-unité α, qui forme le canal, et de deux sous-unités β, qui modulent la perméabilité ionique et la cinétique d'inactivation des canaux sodiques (Fig. 6).

Riz. 6. Structure bidimensionnelle de la sous-unité α du canal sodium voltage-dépendant. Description dans le texte
Comme on peut le voir sur la Fig. 6, la sous-unité a est représentée par quatre domaines du même type, constitués de six segments transmembranaires hélicoïdaux reliés par des boucles d'acides aminés. Les boucles reliant les 5ème et 6ème segments entourent le pore du canal, et le 4ème segment contient des acides aminés chargés positivement, qui sont des capteurs de différence de potentiel sur la membrane et contrôlent la position du mécanisme de porte lors des changements de potentiel transmembranaire.
Dans les canaux sodiques voltage-dépendants, il existe deux mécanismes de porte, l'un d'eux - l'activation (avec la participation du 4ème segment) assure l'ouverture (activation) du canal lors de la dépolarisation membranaire, et le second (avec la participation de la boucle intracellulaire entre le 3ème et le 4ème domaines) - son inactivation lors de la recharge de la membrane. Étant donné que ces deux mécanismes modifient rapidement la position de la porte du canal, les canaux sodiques voltage-dépendants sont des canaux ioniques rapides et sont essentiels à la génération de potentiels d'action dans les tissus excitables et à leur conduction à travers les membranes des fibres nerveuses et musculaires.
Ces canaux sont localisés dans les membranes cytoplasmiques de la butte axonale des neurones, dans les dendrites et les axones, dans la membrane de la région périsynaptique de la synapse neuromusculaire, dans le sarcolemme des fibres des muscles striés et du myocarde contractile. La densité de distribution des canaux sodiques dans ces structures est différente. Dans les fibres nerveuses myélinisées, elles sont concentrées principalement dans la zone des nœuds de Ranvier, où leur densité atteint environ 10 000 canaux par micron carré de surface, et dans les fibres non myélinisées, les canaux sont répartis plus uniformément avec une densité d'environ 20 canaux par carré. micron de surface. Ces canaux sont pratiquement absents dans la structure des membranes du corps des cellules nerveuses, dans la membrane des terminaisons nerveuses qui forment directement les récepteurs sensoriels et dans les membranes postsynaptiques des cellules effectrices.
Parmi les canaux sodiques voltage-dépendants, on distingue déjà plus de neuf sous-types, différant par les propriétés des sous-unités α, ayant une affiliation tissulaire spécifique et différant par une sensibilité différente à l'action des bloqueurs. Par exemple, un sous-type de canal formé par une protéine formant des canaux, dont la synthèse est contrôlée par le gène SCN4A, est présent dans le sarcolemme des muscles squelettiques entièrement différenciés et innervés et ses bloqueurs sont la tétrodotoxine, la saxitoxine et les c-conotoxines. Dans la plupart des cas, les sous-unités α sont sensibles à l'action de la tétrodotoxine, qui, à des concentrations micromolaires, bloque les pores et donc l'entrée des canaux sodiques.
On sait que les toxines des canaux sodiques ralentissent leur inactivation. Par exemple, la toxine de l'anémone de mer (ATX) et la toxine a du scorpion (ScTX) provoquent un retard dans l'inactivation en se liant aux résidus d'acides aminés de la boucle S3-S4 du segment 4.
Substances appelées anesthésiques (novocaïne, dicaine, lidocaïne, sovcaïne, procaïne et etc.). L'anesthésie, lorsqu'ils bloquent les canaux sodiques, est obtenue en éliminant la possibilité de générer des influx nerveux dans les fibres nerveuses afférentes et en bloquant ainsi la transmission des signaux des récepteurs sensoriels de la douleur au système nerveux central.
Il a été découvert que des modifications dans la structure des canaux sodiques peuvent conduire au développement d'un certain nombre de maladies. Par exemple, une modification de la structure du canal contrôlé par le gène SCNlb conduit au développement de formes généralisées d'épilepsie et de convulsions avec augmentation de la température corporelle (convulsions fébriles).
De nombreux micro-organismes forment des toxines dans le corps humain, des substances qui bloquent les canaux ioniques dans les cellules affectées, ce qui peut s'accompagner d'un déséquilibre de l'équilibre ionique et de la mort cellulaire. D’autres micro-organismes, au contraire, utilisent leurs toxines (perforines) pour former des canaux ioniques dans la membrane cellulaire. En particulier, la toxine du bacille du charbon, qui provoque une infection particulièrement dangereuse chez l'homme, attaque la cellule et forme de nouveaux pores (canaux) dans sa membrane par lesquels d'autres toxines pénètrent dans la cellule. L'action de ces toxines provoque la mort des cellules attaquées et une mortalité élevée dans cette maladie. Les scientifiques ont synthétisé une substance β-cyclodextrine, dont la structure spatiale est proche de la forme du canal résultant. Cette substance bloque les canaux formés par la toxine du micro-organisme, empêche l'entrée des toxines dans les cellules et sauve de la mort les animaux expérimentaux infectés par le charbon.
Canaux sodium indépendants de la tension
Canaux sodiques dépendants du ligand. Leur structure générale et leurs propriétés sont discutées ci-dessus dans la description des canaux ioniques dépendants du ligand. Ce type de canaux sodiques est largement représenté dans l'organisme par les canaux sodiques du récepteur cholinergique sensible à la nicotine de la membrane postsynaptique de la synapse neuromusculaire, les synapses interneurones du système nerveux central et du système nerveux autonome (neurones préganglionnaires et ganglionnaires). Les canaux sodiques ligand-dépendants sont localisés dans les membranes postsynaptiques d'autres synapses excitatrices (glutamate et aspartatergiques) du système nerveux central. Ils jouent un rôle crucial dans la génération du potentiel post-synaptique excitateur au niveau des synapses et dans la transmission des signaux entre neurones et entre neurones et cellules effectrices.
Les canaux sodiques ligand-dépendants de la membrane postsynaptique ne sont pas strictement sélectifs et peuvent être perméables simultanément à plusieurs ions : sodium et potassium, sodium et calcium.
Canaux sodium indépendants de la tension, contrôlés par des seconds messagers. L'état de ces canaux sodiques peut être contrôlé par le GMPc (photorécepteurs), l'AMPc (récepteurs olfactifs) et par les sous-unités de la protéine G (myocarde).
Canaux sodiques mécanosensibles. Présent dans les mécanorécepteurs des parois des vaisseaux sanguins, du cœur, des organes internes creux, des propriocepteurs des muscles striés et de la membrane des myocytes lisses. Avec leur participation aux récepteurs sensoriels, l'énergie de l'action mécanique est convertie en une oscillation de la différence de potentiel - le potentiel du récepteur.
Cordes de sodium passives. Contenu dans les membranes cytoplasmiques des cellules excitables. La perméabilité de ces canaux aux ions Na+ est faible, mais à travers eux, les ions Na diffusent selon un gradient de concentration depuis les espaces extracellulaires vers les cellules et dépolarisent quelque peu la membrane. Les canaux sodiques de la membrane cytoplasmique des myocytes lisses sont plus perméables. Ils la dépolarisent davantage (potentiel de repos d'environ 50 mV) que la membrane des myocytes des muscles striés (potentiel de repos d'environ 90 mV). Ainsi, les canaux sodiques passifs sont impliqués dans la formation du potentiel membranaire au repos.
Échangeurs de sodium. L'échangeur sodium-calcium, ou échangeur sodium-calcium, a été décrit précédemment et joue un rôle important dans l'élimination des ions calcium des cardiomyocytes contractiles.
Échangeur de protons sodium. Il s'agit d'un type spécial de protéine formant des canaux qui élimine les protons d'hydrogène des espaces intracellulaires en échange de l'entrée d'ions sodium dans la cellule. L'élimination des protons est activée lorsque le pH de la cellule diminue.
La synthèse des protéines qui forment les canaux d'échange de sodium est contrôlée par cinq gènes, désignés NAH1 -NAH5.
Canaux potassiques
Il existe des canaux potassiques dépendants du potentiel et insensibles au potentiel. Parmi ces derniers, on distingue les canaux potassiques passifs, dépendants du ligand et autres. En règle générale, les canaux potassiques se trouvent dans les membranes des mêmes cellules et tissus qui contiennent des canaux sodiques. L'une des raisons d'un tel parallélisme dans la disposition de ces canaux ioniques est que les ions Na+ et K+ sont les cations les plus importants, dont la nature de la distribution et du mouvement détermine l'émergence et la modification des potentiels électriques comme l'une des formes les plus importantes. de transmission du signal d’information dans le corps.
Il existe toute une superfamille de canaux ioniques potassium, qui sont divisés selon les caractéristiques structurelles, la localisation et les propriétés des canaux en familles, types et sous-types distincts. Plus de trois douzaines de canaux potassiques ont été décrits et il n'est pas possible de donner leurs caractéristiques détaillées. Par conséquent, à titre d'exemples, des descriptions de ces familles et types de canaux ioniques qui sont principalement liés aux voies de signalisation et aux mécanismes de contrôle des processus nerveux et musculaires seront données.
Canaux potassiques passifs
On sait qu'à l'état de repos, les membranes des cellules excitables sont relativement perméables aux ions K et peu perméables aux ions Na+. Puisque les porteurs de courants électriques transmembranaires sont des ions, en mesurant le courant électrique circulant à travers la membrane cellulaire, on peut juger de l'état des canaux ioniques. Il s'est avéré que le courant électrique transmembranaire, provoqué par la diffusion des ions K le long du gradient de concentration depuis la cellule, est d'environ deux picoampères et a un caractère pulsé, et la durée moyenne de la pulsation est de plusieurs millisecondes. De cette observation, il a été conclu que les canaux potassiques dans une cellule au repos peuvent s'ouvrir et se fermer spontanément, fournissant ainsi les conditions nécessaires à la diffusion des ions K à travers eux depuis la cellule et à la formation d'un potentiel de repos sur la membrane.
Canaux potassiques dépendants du potentiel
L'existence de canaux potassiques tension-dépendants dans les membranes cellulaires des tissus excitables est devenue connue après avoir découvert que leur cinétique d'activation diffère de celle des canaux sodiques tension-dépendants et, de plus, qu'ils sont sélectivement bloqués par d'autres bloqueurs. Les canaux potassiques sont activés de la même manière que les canaux sodiques, lorsque la membrane cellulaire est dépolarisée à un niveau critique, mais en même temps, le taux de sortie des ions K+ de la cellule augmente beaucoup plus lentement que le taux d'entrée de Na+. ions dans la cellule.
Le filtre sélectif des canaux potassiques est situé à l'intérieur de l'embouchure des pores, contrairement à l'emplacement externe d'un filtre similaire dans les canaux sodiques (Fig. 7). L'existence d'une sélectivité de ces canaux vis-à-vis des cations Na+ et K+ et de divers bloqueurs spécifiques - tétrodotoxine (pour le sodium) et tétraéthylammonium (pour le potassium) - indique la structure différente de ces canaux.
Les canaux potassiques voltage-dépendants sont des tétramères et se composent de quatre sous-unités formant un pore au centre.
Les canaux potassiques voltage-dépendants sont localisés dans les membranes des cellules excitables et non excitables. Ils jouent un rôle important dans le taux de récupération (repolarisation) du potentiel membranaire après sa dépolarisation et, ainsi, dans le contrôle de la forme et de la fréquence de génération des potentiels d'action. Les canaux potassiques lents sont bloqués par le traéthylammonium, la 4-aminopyridine, la phencyclidine et la 9-aminoacridine.

Riz. 7. Canal potassique : a - gauche - structure bidimensionnelle de la sous-unité a ; à droite, un schéma du canal ; b — diagramme de diffraction électronique des canaux potassiques dans la membrane cytoplasmique.
En plus des canaux potassiques lents, des canaux potassiques rapides voltage-dépendants ont été décrits, dont la cinétique d'ouverture est similaire à celle des canaux sodium rapides voltage-dépendants. Ces canaux potassiques s'ouvrent rapidement lors de la dépolarisation, puis sont complètement inactivés, et leur réactivation nécessite non seulement une repolarisation de la membrane, mais aussi une hyperpolarisation pendant un certain temps.
Conformément aux noms des gènes codant pour la synthèse et l'assemblage de molécules formant des canaux, on distingue six types KCN avec les sous-types KCN A, B, C, E et une famille de canaux ioniques KCNQ. Les canaux de cette dernière famille sont exprimés dans le myocarde.
Canaux potassiques dépendants du ligand
Ils sont représentés par un grand nombre de canaux sensibles à l'action de différents ligands.
Un type de nombreux canaux potassiques dépendants du ligand est le canal associé au récepteur de l'acétylcholine sensible à la muscarine. Ces canaux sont activés par l'acétylcholine. Les canaux peuvent être bloqués par les ions bradykinine et baryum. Il existe deux sous-types de ces canaux : ceux inactivés par la muscarine et ceux activés par celle-ci. Cette dernière est localisée dans les cellules stimulateurs cardiaques du cœur.
Les propriétés d'un canal potassique dépendant du ligand sont possédées par des canaux cationiques non sélectifs et indépendants de la tension qui combinent les caractéristiques des canaux et des récepteurs de l'acétylcholine sensibles à la nicotine de la membrane postsynaptique de la synapse neuromusculaire. Lorsque la protéine formant un canal interagit avec l'acétylcholine, ce canal non sélectif s'ouvre, par lequel les ions Na+ entrent dans la cellule musculaire et les ions K en sortent. Les différentes vitesses de mouvement de ces ions assurent l'apparition d'une dépolarisation de la membrane postsynaptique, qui ne se développe pas en potentiel d'action directement sur cette membrane.
Des canaux potassiques sensibles à l'ATP, inhibés et activés par l'action de l'ATP, ont été identifiés.
Une famille distincte de canaux potassiques comprend ce que l'on appelle les canaux potassiques de rectification d'entrée (portes) ou redresseurs d'entrée. (vers l'intérieurrectifier; vers l'intérieurredresseur). Il n’y a pas de capteur de tension dans le mécanisme de déclenchement du canal potassique redresseur. L'importance fonctionnelle de ces canaux réside dans leur influence sur l'excitabilité des cellules du stimulateur cardiaque, des cellules musculaires et des neurones.
La famille des canaux potassiques entrants rectifiants, selon les noms des gènes qui les codent, est divisée en plus de 15 types. Un exemple de l'importance spécifique de la rectification des canaux potassiques d'entrée et, en particulier, des canaux KCNJ 3, 5, 6 et 9 (une autre désignation des canaux Kir) peut être leur rôle spécifique dans la régulation de la fréquence cardiaque par l'association de ces canaux avec G. récepteurs cellulaires de l'acétylcholine sensibles aux protéines et à la muscarine - stimulateurs cardiaques.
Des canaux potassiques activés par le sodium, insensibles au voltage, sont connus.
Des canaux potassiques spéciaux insensibles au voltage, sensibles aux changements de pH, sont décrits, qui sont présents dans les cellules β des îlots pancréatiques et y agissent comme un capteur de glucose. Les canaux potassiques sont également connus pour être sensibles aux changements de volume cellulaire.
Canaux calciques
La famille des canaux calciques est largement représentée dans les cellules des tissus nerveux et musculaires. Les principaux lieux de localisation sont les membranes des terminaisons présynaptiques du réticulum sarcoplasmique et endoplasmique des muscles, le sarcolemme des cardiomyocytes et les membranes des cellules d'autres tissus.
Sur la base des méthodes de contrôle de la perméabilité, les canaux calciques sont divisés en dépendants de la tension, passifs, dépendants du ligand, mécanosensibles, etc.
Les canaux calciques sont divisés selon le taux d'inactivation en canaux de type T ( transitoire- transitoire), type L (lent). En fonction de l'affiliation tissulaire et de la sensibilité aux toxines, on distingue des canaux de type B (cerveau- cerveau), type N (neuronal- neuronal), type P (purkinjecellule- Cellule de Purkinje) et de type R (résistant aux toxines).
Canaux calciques voltage-dépendants
Ils sont formés par une protéine oligomère, généralement constituée de cinq sous-unités a1, a2, β, y et δ. Le canal ionique lui-même est formé par la sous-unité α, qui présente un degré élevé de similitude dans la composition et la structure des acides aminés avec une sous-unité similaire de canaux sodiques et potassiques voltage-dépendants (voir Fig. 6, Fig. 7).
Le canal calcique voltage-dépendant est sélectivement perméable aux ions Ca 2+. La sélectivité est assurée par la présence d'un pore qui forme un filtre sélectif.
C'est l'heure formé par des segments de la sous-unité a 1, par conséquent, étant donné la similitude de sa structure avec celle des canaux cationiques monovalents, on pourrait s'attendre à ce que le canal calcique soit perméable aux ions Na+ et K+. Cette propriété se produit en réalité lorsque le calcium est éliminé de l’environnement extracellulaire.
En conditions naturelles, la sélectivité envers le calcium est assurée dans le canal par la présence de deux sites de liaison du calcium dans le pore du canal. L'un d'eux est formé par un groupe de résidus glutamate et, à une faible concentration de calcium, il se lie fortement à cette zone du pore du canal et le canal au calcium devient faiblement perméable. À mesure que la concentration de calcium augmente, la probabilité que le calcium occupe un deuxième site de liaison augmente ; les forces de répulsion électrostatiques résultantes entre les ions Ca 2+ réduisent considérablement le temps de séjour des ions sur les sites de liaison. Le calcium libéré se diffuse à travers le canal activé dans la cellule selon un gradient électrochimique.
Les canaux calciques voltage-dépendants diffèrent par les valeurs seuils des changements de différence de potentiel auxquels ils sont activés. Les canaux de type T sont activés par de petits décalages de tension sur la membrane, les types L et P sont caractérisés par des seuils de décalage de tension élevés qui provoquent leur activation.
Les canaux calciques voltage-dépendants jouent un rôle important dans un certain nombre de processus vitaux du corps. Leur activation et l'entrée du calcium dans la terminaison présynaptique sont nécessaires à la transmission du signal synaptique.
L'entrée du calcium par les canaux calciques dans la cellule stimulateur cardiaque est nécessaire pour générer des potentiels d'action dans les cellules stimulateurs cardiaques du cœur et assurer sa contraction rythmique. Les canaux calciques dépendants de la tension régulent le flux de calcium dans le sarcoplasme des fibres du myocarde, des muscles squelettiques, des myocytes lisses des vaisseaux sanguins et des organes internes, contrôlant l'initiation, la vitesse, la force, la durée de leur contraction et donc le mouvement, la fonction de pompage du cœur, tension artérielle, respiration et de nombreux autres processus du corps.
Canaux calciques passifs
Trouvé dans les membranes cytoplasmiques des myocytes lisses. Ils sont perméables au calcium au repos, et le calcium, avec les ions K+ et Na+, participe à la création de la différence de potentiel transmembranaire ou potentiel de repos des myocytes lisses. Le calcium pénétrant dans le myocyte lisse par ces canaux est une source de reconstitution de ses réserves dans le réticulum endoplasmique et est utilisé comme messager secondaire dans la transmission des signaux intracellulaires.
Le calcium au repos peut se déplacer de cellule en cellule via les canaux de jonction lacunaire. Ces canaux ne sont pas sélectifs pour le calcium et des échanges intercellulaires d'autres ions et substances organiques de faible poids moléculaire peuvent se produire simultanément à travers eux. Le calcium entrant dans les cellules par les canaux de jonction lacunaire joue un rôle important dans l'apparition de l'excitation, l'initiation et la synchronisation des contractions du myocarde, de l'utérus, des sphincters des organes internes et dans le maintien du tonus vasculaire.
Canaux calciques dépendants du ligand
Lors de l'étude des mécanismes de déclenchement et de régulation des contractions du myocarde et des muscles lisses, il s'est avéré qu'elles dépendent de l'apport de calcium au myocyte à la fois à partir de l'environnement extracellulaire et de ses réserves intracellulaires. Dans ce cas, l'entrée du calcium dans le sarcoplasme peut être contrôlée par une modification de la différence de potentiel sur le sarcolemme et l'activation de canaux calciques dépendants du potentiel et (ou) l'action d'un certain nombre de molécules de signalisation sur la membrane du réticulum sarcoplasmique. .
Les canaux calciques ligand-dépendants sont localisés dans les membranes cytoplasmiques des myocytes lisses. Les ligands de leurs récepteurs peuvent être des hormones : vasopressine, ocytocine, adrénaline ; le neurotransmetteur norépinéphrine; molécules de signalisation : angiotensine 2, endothélium 1 et autres substances. La liaison du ligand au récepteur s'accompagne de l'activation du canal calcique et de l'entrée de calcium dans la cellule depuis l'environnement extracellulaire.
Dans les cardiomyocytes, pour initier la contraction musculaire, il faut d'abord activer les canaux calciques voltage-dépendants de type T, puis de type L, dont l'ouverture assure l'entrée d'une certaine quantité d'ions Ca 2+ dans la cellule . Le calcium entrant dans la cellule active le récepteur de la ryanodine (RYR), une protéine formant des canaux intégrée dans la membrane du réticulum sarcoplasmique du cardiomyocyte. Suite à l'activation du canal, sa perméabilité au calcium augmente et celui-ci se diffuse dans le sarcoplasme selon le gradient de concentration. Ainsi, les ions Ca 2+ agissent comme une sorte de ligands qui activent les récepteurs de la ryanodine et donc les canaux calciques. En conséquence, le calcium extracellulaire entrant dans la cellule agit comme un déclencheur de la libération du calcium de son principal stockage intracellulaire.
Les canaux calciques peuvent être simultanément sensibles aux changements de différences de potentiel à travers la membrane cytoplasmique et à l'action des ligands. Par exemple, les canaux calciques voltage-dépendants de type L sont sensibles à la dihydropyridine (nifédipine), aux phénylalkylamines (vérapamil) et aux benzothiazépines (diltiazem). Ce type de canal est souvent appelé récepteur de la dihydropyridine. Ce nom suggère que le canal L-calcium est dépendant du ligand, bien qu'en réalité il s'agisse d'un canal dépendant du potentiel.
Les canaux de type P résistent à l'action des conogoxines et des médicaments auxquels d'autres types de canaux calciques sont sensibles.
Les propriétés fonctionnelles des sous-unités α1 des canaux calciques voltage-dépendants peuvent être modulées par leur phosphorylation, et ainsi l'état de perméabilité ionique des canaux calciques, par exemple dans le myocarde, peut être régulé.
Un type particulier de canaux ioniques calcium ligand-dépendants sont des canaux localisés dans les membranes du réticulum endoplasmique des cellules musculaires lisses, dont l'état de perméabilité est contrôlé par le niveau intracellulaire du messager secondaire - IPG. En utilisant ces canaux comme exemple, nous rencontrons un cas où une molécule-agoniste de signalisation extracellulaire, activant le récepteur de la membrane plasmique de la cellule musculaire lisse cible, active la voie de l'inositol phosphate de transmission du signal intracellulaire, qui à son tour, à travers le L'action de l'IPE active la prochaine protéine formant un canal dans la membrane de l'organite cellulaire. Toute cette chaîne d'événements de transmission de signaux se termine par la libération d'ions Ca 2+ des réserves intracellulaires, qui déclenchent et contrôlent le mécanisme moléculaire de contraction des cellules musculaires lisses.
Canaux calciques mécanosensibles
Ils sont localisés dans la membrane plasmique des myocytes lisses des parois des vaisseaux sanguins, de la myoite des organes internes, de l'endothélium vasculaire et de l'épithélium bronchique. Ces canaux peuvent être associés à des mécanorécepteurs glycoprotéiques. En réponse à un stress mécanique (par exemple, étirement de la paroi vasculaire par la pression artérielle), la perméabilité aux ions Ca 2+ augmente. Les canaux mécanosensibles n'ont pas une grande sélectivité et changent simultanément de perméabilité pour un certain nombre de cations. L'entrée de calcium et de sodium dans une cellule musculaire lisse provoque une dépolarisation de sa membrane, l'ouverture de canaux calciques voltage-dépendants, une augmentation de l'entrée de calcium et une contraction du myocyte lisse.
Ces événements font partie du mécanisme d'adaptation du tonus vasculaire et de régulation du flux sanguin aux valeurs changeantes de la pression artérielle dans le vaisseau et de la vitesse du flux sanguin (régulation myogénique). De plus, les canaux calciques mécanosensibles sont impliqués dans la mise en œuvre de mécanismes de stress-relaxation vasculaire lors d'augmentations prolongées de la pression artérielle.
Canaux de chlore
Les canaux chlorure sont présents dans les membranes plasmiques de la plupart des cellules. Ils jouent un rôle important dans le maintien de la différence de potentiel transmembranaire dans une cellule au repos et dans leurs déplacements lorsque l'activité fonctionnelle des cellules change. Les canaux chlorure sont impliqués dans la régulation du volume cellulaire, le transport transépithélial de substances et la sécrétion de fluides par les cellules sécrétoires.
Conformément aux mécanismes d'activation, trois superfamilles de canaux chlore sont distinguées : les canaux chlore voltage-dépendants, ligand-dépendants et autres canaux chlore insensibles au voltage.
Canaux de chlore potentiellement dépendants. Localisé dans les membranes des cellules excitables et épithéliales. L'état de perméabilité de ces canaux est contrôlé par l'ampleur de la différence de potentiel transmembranaire.
La perméabilité dépendante potentielle des canaux chlorure varie selon les tissus. Ainsi, dans la membrane axonale, la dépendance de la perméabilité des canaux chlore à la différence de potentiel est insignifiante et n'affecte pas de manière significative la modification de l'ampleur du potentiel d'action lors de l'excitation, et dans les muscles squelettiques, cette dépendance de la perméabilité des canaux chlore est plus élevé.
Le canal CLC1 est un représentant typique des canaux chlorure de la fibre musculaire sarcolemme du muscle squelettique. Le canal présente une perméabilité sur toute la plage de changements de tension transmembranaire au repos, est activé lors de la dépolarisation et inactivé lors de l'hyperpolarisation membranaire.
Canaux chlorure dépendants du ligand. Principalement exprimé dans le tissu nerveux. L'état de perméabilité de ces canaux chlorure est contrôlé principalement par des ligands extracellulaires, mais ils peuvent être sensibles aux concentrations intracellulaires de calcium et activés par les protéines G et l'AMPc. Les canaux de ce type sont largement distribués dans les membranes postsynaptiques et sont utilisés pour réaliser l'inhibition postsynaptique. L'état de perméabilité des canaux est contrôlé en activant les canaux avec des ligands, des neurotransmetteurs inhibiteurs (acide γ-aminobutyrique et glycine).
Canaux de chlore insensibles à la tension. Comprend des canaux chlorure passifs, des canaux sensibles à l'ATP et un régulateur de conductance transmembranaire de fibrose interstitielle (cystiquefibrosetransmembranaireconductancerégulateur- CFTR).
CFTR se compose apparemment du canal chlore lui-même et d'un canal régulateur représenté par un domaine régulateur spécial (domaine P). La régulation de la conductance ionique de ces canaux est réalisée par phosphorylation du domaine régulateur par la protéine kinase AMPc-dépendante. La violation de la structure et de la fonction de ce canal conduit au développement d'une maladie grave accompagnée d'un dysfonctionnement de nombreux tissus - la fibrose interstitielle.
Aquaporines
Aquaporines(de lat. aqua- eau, grec poreux- canal, pore) - protéines qui forment des canaux d'eau et assurent le transfert transmembranaire de l'eau. Les aquaporines sont des protéines membranaires tétramères intégrales, dont le monomère a une masse d'environ 30 kDa. Ainsi, chaque aquaporine forme quatre canaux d'eau (Fig. 8).
Une particularité de ces canaux est que les molécules d'eau qu'ils contiennent peuvent se déplacer dans des conditions isosmotiques, c'est-à-dire lorsqu'ils ne sont pas affectés par les forces du gradient osmotique. L'abréviation AQP est utilisée pour désigner les aquaporines. Un certain nombre de types d'aquaporines ont été isolés et décrits : AQP1 - dans les membranes épithéliales des tubules rénaux proximaux, la branche descendante de l'anse de Henle ; dans les membranes de l'endothélium et les myocytes lisses des vaisseaux sanguins, dans les structures du corps vitré ; AQP2 - dans les membranes de l'épithélium des canaux collecteurs. Cette aquaporine s'est révélée sensible à l'action de l'hormone antidiurétique et, sur cette base, elle peut être considérée comme un canal hydrique dépendant du ligand. L'expression du gène qui contrôle la synthèse de cette aquaporine est régulée par l'hormone antidiurétique ; AQP3 se trouve dans les membranes des cellules cornéennes ; AQP4 - dans les cellules cérébrales.

Riz. 8. Structure du canal hydrique AQP1 : a - chaînes peptidiques formant le canal ; b — canal assemblé : A, B, C, D, E — sections de la chaîne protéique
Il s’est avéré que AQP1 et AQP4 jouent un rôle important dans la formation et la circulation du liquide céphalo-rachidien. Les aquaporines se trouvent dans l'épithélium du tractus gastro-intestinal : AQP4 - dans l'estomac et l'intestin grêle ; AQP5 - dans les glandes salivaires ; AQP6 - dans l'intestin grêle et le pancréas ; AQP7 - dans l'intestin grêle ; AQP8, AQP9 - dans le foie. Certaines aquaporines transportent non seulement des molécules d'eau, mais aussi des substances organiques qui y sont solubles (oxygène, glycérol, urée). Ainsi, les aquaporines jouent un rôle important dans le métabolisme de l'eau dans l'organisme, et la perturbation de leur fonction peut être l'une des raisons de la formation d'œdèmes cérébraux et pulmonaires et du développement d'une insuffisance rénale et cardiaque.
La connaissance des mécanismes de transport des ions à travers les membranes et des méthodes permettant d'influencer ce transport est une condition indispensable non seulement pour comprendre les mécanismes de régulation des fonctions vitales, mais aussi pour le bon choix de médicaments dans le traitement d'un grand nombre de maladies (hypertension , asthme bronchique, arythmies cardiaques, troubles des échanges eau-sel, etc.).
Pour comprendre les mécanismes de régulation des processus physiologiques dans le corps, il est nécessaire de connaître non seulement la structure et la perméabilité des membranes cellulaires à diverses substances, mais également la structure et la perméabilité de formations structurelles plus complexes situées entre le sang et les tissus de divers organes.